- Kolbe-Elektrolyse
-
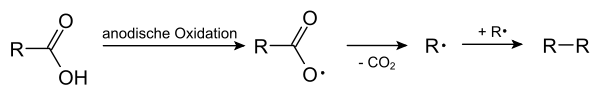
Die Kolbe-Elektrolyse ist eine chemische Reaktion, bei der durch Elektrolyse von Carbonsäuren oder ihren Salzen, den Carboxylaten, zwei Reste aneinander gekuppelt werden. Die Carboxylanionen R-COO− werden dabei anodisch zu Radikalen R-COO• oxidiert, die unter Abspaltung von Kohlenstoffdioxid CO2 zu Radikalen R• zerfallen. Diese verbinden sich (dimerisieren) dann bei hohen Stromdichten, also hohen Radikalkonzentrationen, schnell zum Alkan R-R.
Benannt wurde die Kolbe-Elektrolyse nach ihrem Entdecker Hermann Kolbe, der diese Reaktion erstmals 1849 publizierte. Er stellte auf diese Weise beispielsweise Ethan aus Essigsäure dar.
Für symmetrische n-Alkane kann eine Ausbeute von bis zu 90% erreicht werden, abhängig von Parametern wie Stromdichte, Lösungsmittel, Salzkonzentration und Temperatur. Werden verschiedene Carboxylate eingesetzt (gemischte Kolbe-Elektrolyse), sind auch Produkte mit ungeradzahliger Anzahl von Kohlenstoff-Atomen zugänglich. Die Ausbeuten sinken jedoch, da meist Produktgemische entstehen. Als Anodenmaterial hat sich Platin bewährt.
Die Ausbeuten der Reaktion hängen von verschiedenen Faktoren wie dem Substrat, den speziellen Elektrolysebedingungen, den Stromdichten und den eingesetzten Lösungsmitteln ab. Die Reaktion wird normalerweise bei moderaten Temperaturen durchgeführt.[1]
Einzelnachweise
Literatur
- Kolbe, H.: Untersuchungen über die Elektrolyse organischer Verbindungen. Justus Liebigs Annalen der Chemie 69 (1849), S. 257-294.
- Schäfer, H. J. "CC-Verknüpfungen an Anode und Kathode" Angew. Chem. 1981, 93, 978-1000.
- Laue, T.; Plagens, A.: Namens- und Schlagwortreaktionen der Organischen Chemie. 4. Auflage. B. G. Teubner Verlag, 2004, S. 209-211, ISBN 3-519-33526-3.
Wikimedia Foundation.