- Lactase
-
Lactase —
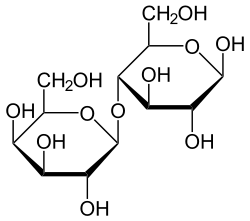
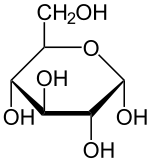
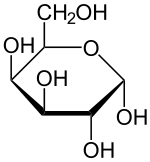
Masse/Länge Primärstruktur 1927 Aminosäuren; 219 kDa Sekundär- bis Quartärstruktur single pass Typ 1 Membranprotein Bezeichner Gen-Namen LCT; LAC; LPH; LPH1 Externe IDs OMIM: 603202 UniProt: P09848 CAS-Nummer: 9031-11-2 Arzneistoffangaben ATC-Code A09AA04 Enzymklassifikation EC, Kategorie 3.2.1.108 Glykosidase Reaktionsart Hydrolyse Substrat Lactose + H2O Produkte D-Galactose + D-Glucose Vorkommen Homologie-Familie Glycosylhydrolase Übergeordnetes Taxon Eukaryoten Lactase (fachsprachlich, Abkürzung: LCT; standardsprachlich: Laktase) ist der Name für das Enzym, das Lactose (Milchzucker) in seine Bestandteile Galactose (Schleimzucker) und Glucose (Traubenzucker) spaltet. Ohne diese chemische Reaktion können die Bestandteile des Milchzuckers nicht durch die Dünndarmschleimhaut aufgenommen werden. Beim Menschen wird das Enzym normalerweise im Kindesalter im Dünndarm produziert, in Europa bei den meisten Menschen dann auch im Erwachsenenalter. Ein Mangel an Lactase kann mehrere Ursachen haben (siehe Lactoseintoleranz) und führt bei 2/3 dieser Personen zu Verdauungsproblemen, wenn Milchzucker aufgenommen wird. Die Lebensmittelindustrie verwendet Lactase, um Milchzucker aus Lebensmitteln zu entfernen. Milchzuckerfreie Lebensmittel werden nicht nur an lactoseintolerante Personen verkauft, milchzuckerfreies Eis hat beispielsweise günstigere Verarbeitungseigenschaften und eine feinere Beschaffenheit.[1][2]
Inhaltsverzeichnis
Biosynthese
Als integrales Membranprotein ist das Verdauungsenzym Lactase in der Bürstensaummembran der säulenförmig angeordneten Hauptzellen des Zottenepithels des Dünndarms lokalisiert. Das für Laktase kodierende Gen liegt auf dem zweiten Chromosom (2q21 [3]) und kam – nach aktuellen Untersuchungen – vermutlich durch nomadische Hirtenstämme aus dem Ural nach Europa, da die isolierte DNA aus 5000 Jahre alten Skeletten von Erwachsenen aus Zentral- und Osteuropa diese Mutation noch nicht trug.
Das LCT-Gen erstreckt sich über 17 Exons und 49.340 Basenpaare. Nach der Transkription entsteht mRNA, die 6274 Basen enthält und zu einem 1927 Aminosäuren langen Molekül Lactase übersetzt wird.[4]
Katalysierte Reaktion
Lactose wird in Glucose und Galactose gespalten. Die optimalen Bedingungen für die Laktase liegen bei einem pH-Wert von 6,5 und einer Temperatur von 48 °C.
Industrielle Nutzung
Kommerziell produzierte Lactase wird aus Hefepilzen wie Kluyveromyces fragilis gewonnen. Das so gewonnene Enzym wird in Form von Tabletten und Kapseln angeboten, damit Menschen, welche unter Laktoseintoleranz leiden, Milchprodukte zu sich nehmen können. Auch gibt es lactosefreie Milch, bei welcher die Lactose bereits durch Zusatz von Lactase aufgespaltet wurde. Damit ist Milch für Menschen genießbar, denen das Enzym Lactase fehlt.
In der Herstellung von Speiseeis wird Lactase eingesetzt, da die Spaltprodukte Glucose und Galactose süßer sind als die Lactose und somit der Zuckerzusatz eingeschränkt werden kann. Außerdem kristallisiert Lactose bei tiefen Temperaturen, bei denen Speiseeis vorliegt, während die Spaltprodukte weiterhin gelöst vorliegen und dem Eis so eine feinere Beschaffenheit verleihen.
Mengenangaben werden mit der Einheit FCC ausgedrückt. 1000 FCC entsprechen 70 Milligramm Lactase und können 5 Gramm Milchzucker abbauen.[5].
Siehe auch
Einzelnachweise
- ↑ UniProt-Eintrag
- ↑ P. Born: DD unspezifischer Abdominalbeschwerden: die Kohlenhydratmalabsorption. In: Münch. Med. Wschr.. 139, Nr. 29, 1997, S. 32/436-36/440.
- ↑ GeneID 3938
- ↑ ENSEMBL-Eintrag
- ↑ Informationen zur Quantität der Wirkung
Weblinks
- Laktonaut Wiki-Datenbank mit laktosefreien Lebensmitteln
Wikimedia Foundation.