- Lasermikrotom
-
Ein Mikrotom (von griech. mikros „klein“ und temnein „schneiden“) ist ein Schneidegerät, mit dem man sehr dünne Schnitte erstellen kann. Es dient zur Herstellung mikroskopischer Präparate, welche später durchstrahlt werden sollen (beispielsweise biologische Gewebe). Typische Einsatzgebiete sind vor allem weiche Materialien und Werkstoffe, wie beispielsweise aus der Medizin und Biologie (Histotechnik), sowie die Analytik von Kunststoffen. Biologisches Material wird normalerweise vor dem Schneiden durch Fixierung gehärtet und dann durch „Einbettung“, das heißt Einschluss mit einer flüssigen Substanz (Paraffin, Kunstharz), die später aushärtet, schneidbar gemacht. Für die Erstellung der Schnitte stehen je nach Anwendungsgebiet verschiedene Mikrotomarten zur Verfügung. Die Dicke der Schnitte ist dabei deutlich geringer als der Durchmesser eines menschlichen Haares und liegt bei typischerweise 0,1 bis 100 µm. Die Anwendung eines Mikrotoms wird als Mikrotomie bezeichnet.
Alternativverfahren für die Herstellung dünner Präparate sind der Dünnschliff für Metalle, Gesteine, Mineralien, Knochen und Zähne, die Elektropolitur für Metalle und die Ionendünnung.
Inhaltsverzeichnis
Geschichte
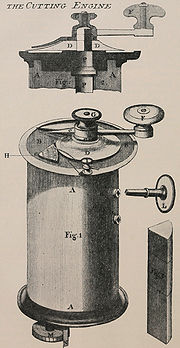
Um den Aufbau eines Objektes zu verstehen, muss man sein Inneres untersuchen. In den Anfängen der Lichtmikroskopie wurden dazu Handschnitte mit Rasierklingen, meist von Pflanzen oder Teilen von Tieren, erstellt. Will man die Strukturen eines Objektes sehr genau erkennen, so benötigt man sehr dünne, gleichmäßige Schnitte in der Größenordnung von 10-100 µm, die im Durchlicht untersucht werden können. Die Geräte zur Anfertigung von Schnitten wurden bis 1839 Schneidapparate (cutting engine) genannt, bis Jacques Louis Vincent (1770–1841) und Charles Louis Chevalier (1804–1859) den Begriff „Mikrotom“ prägten.[2]
Das vermutlich erste Gerät zur Anfertigung derartiger Schnitte wurde um 1770 von George Adams, jr. (1750-1795) erfunden und von Alexander Cumming weiterentwickelt.[3] Es war ein Handmodell, bei dem die Probe in einem Zylinder festgehalten und die Schnittdicke (Höhe der Probe) mit einer Schraube eingestellt wurde.[1][4] 1835 baute Andrew Pritchard das Schnittgerät in ein Tischmodell um, indem er es mit einer Klammer an einem Tisch befestigte und so das Messer beidhändig bedienen konnte.[5]
Das erste Schlittenmikrotom wurde 1798(?) von George Adams erfunden.[2] Die Entwicklung der Rotationsmikrotome erfolgte hingegen erst deutlich später (1883 bzw. 1886).[2]
Um dünne Schnitte erzeugen zu können, wurden auch andere Hilfsmittel wie etwa 1838 das Doppelklingenmesser mit verstellbarem Klingenabstand von Gabriel Gustav Valentin entwickelt.[6][7] Aufgrund der erst in Anfängen vorhandenen Härtungstechnik von biologischen Proben und mechanischen Problemen (Stabilität und Nachschärfbarkeit der Klingen) führte diese offensichtliche Lösung, ein Doppelklingenmesser, im Freihandbetrieb nicht zum gewünschten Erfolg.
Häufig wird in der Literatur als Erfinder des Mikrotoms der Anatom Wilhelm His angesehen (1865).[8][9] In seiner Beschreibung eines Mikrotoms von 1870 schreibt His: "Der Apparat hat mir eine Präcision der Arbeit erlaubt, welche bei der Schnittführung mit einer Hand niemals möglich gewesen wäre. Er hat mir nämlich möglich gemacht, ununterbrochene Schnittfolgen der untersuchten Objecte zu gewinnen." Gleichzeitig gibt er jedoch auch an, dass (in der Literatur) zur Herstellung von mikroskopischen Schnitten (bereits) eine Anzahl von Vorrichtungen angegeben worden seien und dass sein Gerät eine Erweiterung eines Queerschnitters von Herrn Professor Hensen darstellt.[10] Der Grund für die Nennung als Erfinder mag sein, dass Wilhelm His mit seinen Arbeiten maßgeblich zu einer breiten Akzeptanz des Gerätes beitrug.[11]
Andere Quellen beschreiben, dass das Mikrotom, ein Gerät zum Schneiden dünner Anteile von Geweben, vom tschechischen Physiologen Jan Evangelista Purkyně erfunden wurde.[12] Mehrfach wird auch ohne Angaben von Jahreszahlen berichtet, das Purkinje das Mikrotom als erster nutzte.[13][14] Die Unklarheiten bzgl. der Erfindung des Mikrotoms könnten zum Einen damit zusammenhängen, dass die ersten Mikrotome nur als Schneidapparate (cutting engine) und nicht als Mikrotome bezeichnet wurden oder dass abhängig vom Entwicklungsstadium die ersten Geräte unberücksichtigt blieben.
Zusammen mit den Mikrotomen entwickelte sich auch die Präparationstechnik – bestehend aus Fixiertechnik, Einbettung und Anfärbung von Präparaten – immer weiter. Die selektive Anfärbung des Präparats führt jedoch nur dann zu brauchbaren Ergebnissen, wenn die Probendicke konstant bleibt. Man verhinderte damit, dass Unterschiede in der Dicke zu größeren Farbänderungen führen als Unterschiede in der Probenstruktur. Die Erstellung von sehr dünnen und vor allem gleichmäßig dicken Schnittpräparaten mit einem Mikrotom hatte daher, zusammen mit der selektiven Anfärbung bestimmter Zellkomponenten oder Moleküle, die Sichtbarkeit mikroskopischer Details Ende des 19. Jahrhunderts um mindestens eine Größenordnung erhöht.[15][16]
Wichtige Hersteller von Mikrotomen waren die Firmen C. Reichert, Wien, R. Jung, Heidelberg und E. Leitz, Wetzlar, deren entsprechende Geschäftsbereiche inzwischen alle in der Leica-Microsystems AG, Wetzlar aufgegangen sind.[17]
Eine ausführliche Abhandlung über die Geschichte des Mikrotoms findet sich in der Übersichtsarbeit von Gilbert Morgan Smith.[5] Dort finden sich auch zahlreiche historische Abbildungen der frühen Geräte. Aufbauend hierauf gibt Krause einen eurozentrischen Blick auf die Geschichte des Mikrotoms.[18]
Mechanische Mikrotome
Die meisten Mikrotome bestehen aus einem Messerblock mit auswechselbarem Messer, einem Präparatehalter mit Probe und einem „Vorschubmechanismus“. Je nach Gerätetyp wird beim Schneiden die Probe oder das Messer bewegt, wobei das Messer durch das Präparat gedrückt wird und durch die Keilwirkung eine hauchdünne Schicht abschneidet (Schnittgewinnung). Nach jedem Schnitt sorgt der Vorschubmechanismus für eine automatische Verschiebung, die sogenannte Zustellung, so dass beim nächsten Zyklus ein Schnitt der gleichen Dicke erzeugt wird. Die Schnittdicke lässt sich über einen entsprechenden Einstellmechanismus genau regulieren.
Je nach Aufbau werden verschiedene Gerätetypen unterschieden. Die wichtigsten Typen werden im Folgenden beschrieben. Die angegebenen Schnittdicken stellen Orientierungswerte dar. Die sinnvolle Schnittdicke ist abhängig vom Material der Probe, dem Untersuchungsziel und von der Vorbehandlung (Fixierung, Einbettung, Histotechnik).
Schlittenmikrotom
Beim Schlittenmikrotom ist das Präparat meist fest auf einem Blockträger fixiert, während das Messer auf einem meist schweren „Schlitten“ hin und her bewegt wird. Der Schlitten befindet sich heutzutage auf einem auf Rollen gelagerten Band.[19] Das Messer kann bei vielen Schlittenmikrotomen zur Schnittrichtung schräggestellt werden. Dieser Winkel wird auch als Deklination bezeichnet.[19] Diese Orientierung reduziert im Vergleich zu einem quergestellten Messer den Druck beim Schneiden. Typische Anwendungsgebiete sind große, weiche Proben, z. B. in Paraffin eingebettete biologische Präparate. Die typische Schnittdicke des Schlittenmikrotoms liegt bei 1 bis 60 µm (evtl. bis 300 µm).
Alternativ findet man zum Teil auch eine Variante des Schlittenmikrotoms im Einsatz, das als Grundschlittenmikrotom bezeichnet wird. Hier ist das Messer starr angebracht und die Probe wird auf der Schlittenbahn unter dem Messer durchgezogen.[17]
Rotationsmikrotom
Die Instrumente dieses Typs werden auch als Minotmikrotom bezeichnet. Sie werden zwar durch eine Drehbewegung angetrieben, diese wird aber in eine geradlinige Bewegung umgewandelt, so dass die eigentliche Schnittbewegung (die hier vom Objekt ausgeführt wird) in einer einfachen Auf- und Abwärtsbewegung besteht. Beim Rotationsmikrotom ist das Messer typischerweise horizontal und feststehend angeordnet.[17]
In der nebenstehenden Skizze ist das Grundprinzip eines Schnittvorgangs erklärt. Durch die Abwärtsbewegung des Probenhalters wird das Messer durch die Probe gedrückt (Position 1 nach Position 2). Der Dünnschnitt kommt dabei auf dem Messer zu liegen. Nach erfolgtem Schnitt wird die Probenhalterung leicht zurückgezogen damit die Probe bei der nun folgenden Aufwärtsbewegung nicht am Messer entlang schleift. Am höchsten Punkt der Bewegung erfolgt die Zustellung der Probe, das heißt, der Probenhalter wird nun soweit nach vorne bewegt, dass bei der nächsten Abwärtsbewegung ein Dünnschnitt gleicher Schnittdicke entsteht. Der Schnitt kann entweder einzeln vom Messer abgenommen werden oder man wartet, bis sich mehrere aufeinander folgende Schnitte zu einem Schnittband aneinander gereiht haben und nimmt diese als Band ab (vgl. Bild rechts).
Das Schwungrad kann bei vielen Mikrotomen auch von Hand gedreht werden. Es hat außerdem den Vorteil, dass ein sauberer Schnitt erfolgt, da durch die relativ große Masse des Schwungrades Unterschiede in der Härte der Probe nicht sofort zu deutlichen Geschwindigkeitsänderungen im Schnitt führen. Das rotierende Schwungrad ist bei einigen neueren Modellen auch im Gehäuse integriert. Die typische Schnittdicke des Rotationsmikrotoms liegt bei 1 bis 60 µm (eventuell bis 300 µm). Für harte Materialien (z. B. Einbettungen in Kunstharze) sind bei guten Geräten auch Semidünnschnitte mit einer Dicke im Bereich von 0,5 µm möglich.
Gefriermikrotom
Zum Schneiden von gefrorenen Proben können viele Rotationsmikrotome durch Adaption einer mit flüssigem Stickstoff gekühlten Kammer (die Probe befindet sich während des Schneidens praktisch in einem oben offenen Tiefkühlschrank) in ein sogenanntes Gefrier- oder Kryomikrotom umgebaut werden. Die tiefe Temperatur wird dazu genutzt, um die Härte der Probe zu erhöhen und damit schneidfähig zu machen. Dieses betrifft hauptsächlich Geräte, die für die Ultramikrotomie oder auch für Semidünnschnitte geeignet sind.[19] Bei der Erstellung der Schnitte muss sowohl die Probentemperatur als auch die Messertemperatur geregelt und für das Probenmaterial und die Schnittdicke optimiert werden.
Daneben gibt es aber in der Histotechnik auch Kryostate, die für schnelle Gewebeschnitte optimiert sind und sich das komplette Mikrotom innerhalb der Kühlkammer befindet.[17] Alle Arbeitsschritte vom Schnellgefrieren, über das Schneiden bis zum Aufziehen auf einen Objektträger finden im Gerät statt.[20]
Ultramikrotom
Ein Ultramikrotom dient zur Herstellung extrem dünner Schnitte und funktioniert wie ein „normales“ Rotationsmikrotom, allerdings ist die Mechanik konstruktiv auf einen sehr feinen Vorschub ausgerichtet. Statt eines mechanischen Vorschubs ist hier auch ein Vorschub durch die kontrollierte Längenausdehnung des Präparatehalters mittels Erwärmung gebräuchlich.[19] Solche extrem dünnen Schnitte werden vor allem für Untersuchungen mit dem Transmissionselektronenmikroskop, seltener auch für lichtoptische Mikroskope benötigt.[17] Die typische Dicke eines Schnitts liegt zwischen 10 und 500 nm. Durch die geringe Dicke der Schnitte ist ein direktes Abnehmen vom Messer schwierig. Daher werden die Schnitte meist auf der Oberfläche einer Flüssigkeit (z. B. Wasser) geschnitten und anschließend abgefischt. Die Schnittdicke und -gleichmäßigkeit kann über Interferenzfarben abgeschätzt werden.
Vibratom
Bei Vibratomen wird die Schneidwirkung durch eine vibrierende Klinge (z. B. Rasierklinge) erzeugt. Der Schnitt erfolgt weniger durch Druck als durch die seitlichen Bewegungen der Klinge. Vibratome setzt man vor allem für unbehandelte biologische Proben ein.[19] Durch die geringere mechanische Belastung kann hier auf die Einbettung der Probe verzichtet werden. Durch die Vibration ist das Schnittbild jedoch meist deutlich schlechter als bei den erstgenannten Mikrotomtypen. Die Schnittdicke beträgt über 30 µm.
Sägemikrotom
Das Sägemikrotomen ist besonders für sehr hartes Material wie z. B. Knochen und Zähne geeignet. Bei Mikrotomen dieses Typs rotiert eine diamantbesetzte Innenlochsäge, die sich in einem definierten Abstand durch das Präparat schleift. Die minimale Schnittdicke liegt über 30 µm und ermöglich also nur vergleichsweise grobe Schnitte.[19]
Laser-Mikrotom
Das Laser-Mikrotom[21] ist ein Instrument zum berührungslosen Schneiden von Proben. Es eignet sich neben den herkömmlichen Anwendungen von Mikrotomen insbesondere zum Schneiden von biologischen Geweben im nativen Zustand (z. B. Leber, Niere, Haut usw.). Eine Vorbereitung der Proben durch Einbetten, Einfrieren oder chemisches Fixieren ist nicht erforderlich. Dadurch wird die Bildung von Artefakten weitgehend vermieden. Andererseits können auch sehr harte Materialien wie Knochen und Zähne oder sogar Keramiken 'geschnitten' werden. Abhängig von den Eigenschaften des Probenmaterials sind derzeit Schnittdicken von 10 bis 100 µm möglich.
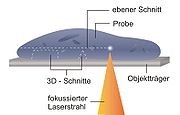
Im Gegensatz zu mechanisch arbeitenden Mikrotomen dient hier ein Ultrakurzpulslaser als Schneidewerkzeug. Der Laser emittiert Strahlung im nahen Infrarot-Bereich. In diesem Wellenlängenbereich kann der Laser biologische Gewebe, aber auch andere Materialien, bis zu einer bestimmten Tiefe ohne sichtbare Schädigung durchdringen. Durch eine starke Fokussierung in das Innere der Probe kommt es im Fokuspunkt zu sehr hohen Intensitäten von über einem TW/cm². Die dadurch bedingten nichtlinearen Wechselwirkungen führen zum sogenannten optischen Durchbruch, der eine auf den Fokus begrenzte Materialtrennung induziert. Dieser Prozess wird auch als Photodisruption bezeichnet. Durch die kurzen Pulsdauern von einigen Femtosekunden (1 fs = 10−15 s), wird pro Puls nur eine sehr kleine Energiemenge im Bereich von wenigen Nanojoules in der Probe deponiert. Das limitiert die Interaktionszone auf einen Durchmesser von unter einem Mikrometer. Außerhalb dieser Zone treten aufgrund der ultrakurzen Wechselwirkungszeiten keine thermischen Schäden auf.
Der Laserstrahl wird durch einen schnellen Scanner-Spiegel abgelenkt, während eine dreidimensionale Positioniereinheit die Probe gleichzeitig hin und her bewegt. In Kombination mit einer hohen Repetitionsrate ermöglicht diese Vorgehensweise das Abscannen größerer Flächen innerhalb kurzer Zeit.
Neben dem Laser-Mikrotom gibt es auch die Laser-Mikrodissektion zum Ausschneiden von Arealen innerhalb eines Gewebeschnittes, Zellausstriches u. ä. oder zum Sortieren von kleinen Teilchen.
Mikrotommesser
Die Art der verwendeten Mikrotommesser steht in Abhängigkeit zum Material und der Vorbehandlung der Probe, sowie zum Untersuchungsziel (z. B. Schnittdicke).
Messerarten und Schlifftypen
Klassischerweise werden relativ schwere Stahlmesser oder auch Hartmetallmesser mit dickem Rücken und mit verschiedenen Formen (Profil) verwendet, die allgemein mit den Buchstaben A, B, C und D gekennzeichnet werden. Die Mikrotommesser vom Schlifftyp A und B sind durch die plankonkave Form extrem scharf, aber auch sehr empfindlich und somit nur für sehr weiche Proben wie Paraffin oder geschäumtes Material geeignet.[17] Die Keilform beim Schlifftyp C ist deutlich stabiler und findet dadurch auch für etwas härtere Materialien wie Kunstharz oder auch für Gefrierschnitte Verwendung.[17] Beim Messertyp mit Schliffform D ist nur eine Seite des Messers angeschliffen. Der vordere Schliffwinkel von ca. 45° erhöht die Stabilität nochmals, macht das Messer jedoch auch sehr viel stumpfer. Diese Messerform wird nur noch für härtere Materialien verwendet.[17]
Statt dieser klassischen Mikrotommesser werden z. B. zur Kostenersparnis häufig Einmalklingen verwendet. Diese sind teilweise etwas stumpfer als die klassischen Mikrotommesser, aber vor allem deutlich dünner und damit flexibler. Bei härteren Proben kann es daher zu Schwingungen des Messers und damit zu Schichtdickenschwankungen im Schnitt kommen. Einmalklingen werden daher hauptsächlich für weichere Materialien eingesetzt.
Für Ultramikrotome benötigt man Glas- bzw. Diamantmesser. Die Schnittbreite derartiger Messer ist mit wenigen Millimetern deutlich geringer als bei den klassischen Mikrotommessern. Glasmesser werden unmittelbar vor Gebrauch aus wenigen Millimeter dicken Glasstäben durch Brechen hergestellt. Hierbei entsteht an der Schmalseite des zu Dreiecken gebrochenen Glases eine äußerst glatte und scharfe Bruchkante. Glasmesser werden typischerweise zum Vorschneiden des Präparates (Antrimmen) genutzt. Sie können, beispielsweise durch Klebeband, um einen kleinen Trog ergänzt werden, der mit Wasser gefüllt wird. Wie bei Diamantmessern können die Einzelschnitte dann auf der Wasseroberfläche aufschwimmen.[19]
Schärfe und Härte der Messer sind entscheidend für ein gutes Ergebnis. Abgestumpfte Stahlmesser werden mit speziellen Schleifpasten geschliffen, die Diamantpartikel enthalten. Dafür existieren spezielle Schleifapparate. Handschleifen auf Schleifriemen und Stöcken ist auch möglich, setzt aber viel Erfahrung voraus.[17]
Schneidewinkel: Deklination und Inklination
Als Deklination wird der Winkel zwischen der Richtung der Messerschneide und der Schnittrichtung bezeichnet (siehe Abbildung rechts). Sie lässt sich bei vielen Schlittenmikrotomen zwischen 90° und 160° einstellen.[19] Ist das Messer quergestellt (Deklination=90°), so erfolgt der Schnitt ausschließlich indem das Messer durch die Probe gedrückt wird. Die dabei auf das Messer einwirkenden Kräfte sind deutlich größer, als wenn das Messer schräg zur Schnittrichtung orientiert ist (Deklination 120° bis 160°).[17] In letzterem Fall erleichtert eine Relativbewegung mit einem Anteil parallel zur Messerschneide den Schnitt. Diese Einstellung wird besonders bei großen und harten Materialien verwendet.[19] Der Vorteil der quergestellten Variante ist, dass bei geeignetem Material Schnittbänder (Aneinanderreihung mehrerer Schnitte) erstellt werden können.[17]
Als Inklination wird die Neigung des Messers zur Präparatebene bezeichnet. Für ein optimales Schnittergebnis muss dieser Winkel geeignet gewählt werden. Er hängt von der genauen Messergeometrie, der Probe, der Schnittgeschwindigkeit und vielen weiteren Parametern ab.[17] Typisch sind Neigungswinkel, bei denen zwischen Präparatebene und Messer ein geringer Freiwinkel von wenigen Grad bleibt.
Wird dieser Winkel zu flach eingestellt, so schneidet das Messer ungleichmäßig, oder Bereiche des unteren Teils des Messers berühren die frische Schnittfläche, so dass diese verschmiert wird.[17]
Wird der Winkel hingegen zu groß gewählt, so „rumpelt“ das Messer über die Oberfläche und es kommt zu periodischen Dickenvariationen im Schnitt.[19] Bei noch größerem Inklinationswinkel ist die seitliche Belastung auf die Schneide extrem groß, und es kann zu Ausbrüchen an der Messerschneide kommen.
Vor- und Nachbereitung der Proben
Biologische und andere weiche Materialien benötigen eine aufwändige Vorbehandlung, um sie zu verfestigen und dadurch schneidfähig zu machen. Die Methoden dieser Vorbehandlung wie Fixieren und Einbetten sind Teil der Histotechnik. Zum Einbetten wird das Objekt in der Regel vollständig mit einer Flüssigkeit durchtränkt, die anschließend zum Erstarren gebracht wird. Auf diese Weise erhält das Präparat durchgehend ziemlich gleichmäßige Festigkeit. Typische Einbettmedien sind Paraffin, Polyethylenglykol, Celloidin, Gelatine, Agar und Kunstharze. [22]
Für manche Untersuchungen wird die Verfestigung des zu schneidenden Materials durch Einfrieren erreicht, z. B. wenn eine Einbettung zu einer Veränderung der Probe führen oder eine anschließende Färbung verhindern würde. Wasserhaltige Proben müssen mit einer Abkühlrate von mindestens 10000 K/s (Kelvin pro Sekunde) schockgefroren werden, damit sich das Wasser im amorphen Zustand verfestigt. Sonst bilden sich Eiskristalle, die zu Gefrierschäden im Material führen.[22] Die Schnitte werden dann an Gefriermikrotomen, meist bei −20 °C, hergestellt.
Nach dem Schneiden muss der Schnitt für die weitere Verarbeitung (z. B. histochemische, immunhistochemische Färbungen) auf einen Träger übertragen werden. Für lichtmikroskopische Präparate werden Objektträger verwendet. Größere Paraffinschnitte lässt man zuerst auf eine Wasseroberfläche (45 °C) aufschwimmen und durch die Oberflächenspannung glätten. Anschließend wird ein Objektträger unterhalb der Wasseroberfläche schräg unter den Schnitt geschoben und dann vorsichtig nach oben bewegt. Der Schnitt bleibt mit einer Kante durch Adhäsionskräfte am Glas hängen und wird dadurch auf den Objektträger aufgezogen. Das gleiche Prinzip wird auch bei ultradünnen Schnitten für die Elektronenmikroskopie verwendet, die für ein mechanisches Abheben zu dünn und instabil sind. Hier ist der Flüssigkeitstrog direkt am Messer angebracht. Die Schnitte bilden ein Schnittband (siehe Bild Ultramikrotom) und werden dann mit einem feinen Metall-Netzchen (engl. grid) abgefischt.
Anwendung
In der Histologie (Gewebelehre) ist die Anfertigung von Schnitten eine Grundvoraussetzung für die Untersuchung von Gewebemerkmalen. Spezielle Gefriermikrotome (Kryostate) werden unter anderem zur Schnellschnittdiagnostik eingesetzt um während der Operation Klarheit über die Vollständigkeit der Entfernung eines Tumors zu erhalten. Aufgrund der Ergebnisse wird über das weitere Vorgehen bei der Operation entschieden.[23]
Daneben werden Mikrotome für Werkstoffanalysen eingesetzt. Hier sei beispielsweise die lichtmikroskopische oder spektroskopische Untersuchung von Schichtsystemen (speziell mikroskopische IR-Spektroskopie in Transmission) oder die polarisationsmikroskopische Untersuchung von Sphärolithen zu nennen. Für die Transmissionselektronenmikroskopie sind sehr dünne Schnitte notwendig, um diese mit Elektronen durchstrahlen zu können.
In der Augenheilkunde werden im Rahmen der refraktiven Chirurgie sogenannte Mikrokeratome (eine Art Hornhauthobel) eingesetzt, um ein ca. 150 µm dickes Hornhautläppchen (auch Flap genannt) zu schneiden, um die darunter liegenden Hornhautschichten für eine Operation freizulegen.[24] [25] Dieses Gerät wird manchmal ebenfalls als Mikrotom bezeichnet.[26]
Einzelnachweise
- ↑ a b John Hill: The Construction of Timer, from its early growth; Explained by Microscope, and proven from Experiments, in a great Variety of Kinds., S. 5–11, Plate I 1770
- ↑ a b c Gretchen L. Humason: Animal tissue techniques, S. 43, Chapter 4 (Microtomes and Microtome Knives), W. H. Freeman and Company 1962
- ↑ John Quekett: A Practical Treatise on the use of the Microscope, S. 306, Chapter XII (Microtomes and Microtome Knives), London: Hippolyte Bailliere 1848
- ↑ Anonymous: An eighteenth century Microtome. In: Journal of the Royal Microscopical Society. The Royal Microscopical SocietyOxford, England1910, S. 779-782
- ↑ a b Gilbert Morgan Smith: The Development of Botanical Microtechnique. In: Transactions of the American Microscopical Society 34, Nr. 2. 1915, S. 71–129, (PDF-Version des Artikels)
- ↑ Peter Harting: Das Mikroskop., S. 363–366, Abschnitt 292, Braunschweig: F. Vieweg & Sohn 1859
- ↑ Erich Hintzsche: Voraussetzungen und Entwicklung der Mikrotomie. In: Ciba-Zeitschrift (Basel). Nr. 8, 1943, S. 3082-3084 (PDF).
- ↑ Wilhelm His. In: Encyclopædia Britannica Online. Encyclopædia Britannica. Abgerufen am 24. März 2009.
- ↑ Marios Loukas, Pamela Clarke, R. Shane Tubbs, Theodoros Kapos and Margit Trotz: The His family and their contributions to cardiology. In: International Journal of Cardiology. 123, Nr. 2ElsevierIreland, 2008, S. 75–78. doi:10.1016/j.ijcard.2006.12.070
- ↑ Wilhelm His: Beschreibung eines Mikrotoms. In: Archiv für mikroskopische Anatomie. 6Verlag Max Cohen & SohnBonn, 1870, S. 229–232, Tafel III. doi:10.1007/BF02955980
- ↑ Ole Daniel Enersen: Wilhelm His.
- ↑ Histology. In: msn Encarta. msn Encarta. Abgerufen am 18. März 2009.
- ↑ Detlev Ganten: Handbuch der molekularen Medizin, Springer, ISBN 3540645527, (Google-Books)
- ↑ Werner Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (2005): Enzyklopädie Medizingeschichte, Walter de Gruyter, ISBN 3110157144, (Google-Books)
- ↑ Ernst Mayr: Die Entwicklung der biologischen Gedankenwelt. Springer, 2002, ISBN 3-54043-213-2 (Google-Books)
- ↑ Werner Linß, Werner Linb, Jochen Fanghänel: Histologie: Zytologie, allgemeine Histologie, mikroskopische Anatomie. Walter de Gruyter, 1998, ISBN 3-11014-032-2 (Google-Books)
- ↑ a b c d e f g h i j k l m Klaus Henkel: Das Schneiden mit dem Mikrotom. Mikrobiologische Vereinigung München e. V., 2006, abgerufen am 15. Feb. 2009
- ↑ Rudolf Krause: Enzyklopädie der Mikroskopischen Technik, S. 1528–1548, Band II, Berlin: Urban & Schwarzenberg 1926 (3. Auflage)
- ↑ a b c d e f g h i j Gudrun Lang: Histotechnik. Praxislehrbuch für die Biomedizinische Analytik. Springer, Wien/New York 2006, ISBN 3-211-33141-7 (Google Books).
- ↑ Stephen Peters: Frozen section technique. Pathology Innovations (Anleitung und Videos zur Gefrierschnitttechnik, englisch)
- ↑ Holger Lubatschowski 2007: Laser Microtomy, WILEY-VCH Verlag GmbH, Biophotonics, S. 49-51, (PDF).
- ↑ a b Irene K. Lichtscheidl (Hrsg.): Lichtmikroskopie - Theorie und Anwendung. In: Lichtmikroskopie online - Theorie und Anwendung. Universität Wien, abgerufen am 15. Feb. 2009 (PDF)
- ↑ A. Turzynski (Hrsg.): Schnellschnittdiagnostik. Pathologie Lübeck, 15. Feb. 2009.
- ↑ T. Kohnen (Hrsg.): Mikrokeratome. abgerufen am 15. Feb. 2009 (Schematische Beschreibung der Arbeit mit dem Mikrokeratom)
- ↑ Internet Media Services, Inc. (Hrsg.): Understanding LASIK. abgerufen am 15. Feb. 2009 (Beschreibung der Laser-in-situ-Keratomileusis (LASIK), incl. Video einer Operation, englisch)
- ↑ Steven H. Schwartz: Geometrical and Visual Optics. McGraw-Hill, 2002, ISBN 0071374159 (Google-Books)
Weblinks
- Das Schneiden mit dem Mikrotom
- Video zum Schneiden mit dem Mikrotom (englisch) bei YouTube. Abgerufen am 3. März 2009.
Wikimedia Foundation.






_svg.png)




_bei_der_Mikrotomie__svg.png)
_bei_der_Mikrotomie_svg.png)