- Metaldehyd
-
Strukturformel 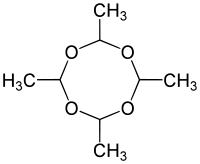
Allgemeines Name Metaldehyd Andere Namen - 2,4,6,8-Tetramethyl-1,3,5,7-tetroxocan,
- Metacetaldehyd
Summenformel C8H16O4 CAS-Nummer 108-62-3
9002-91-9 HomopolymerPubChem 61021 Kurzbeschreibung farbloser, geschmackloser, leichtentzündlicher Feststoff mit schwachem charakteristischem Eigengeruch[1][2]
Eigenschaften Molare Masse 176,21 g·mol−1 Aggregatzustand fest
Dichte 1,27 g·cm−3 [3]
Schmelzpunkt Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [6] 

Gefahr
H- und P-Sätze H: 228-302 EUH: keine EUH-Sätze P: 210-260-284-301+310-310 [7] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [6] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-22 S: (2)-13-16-25-46 LD50 227–690 mg·kg−1 (oral Ratte)[8]
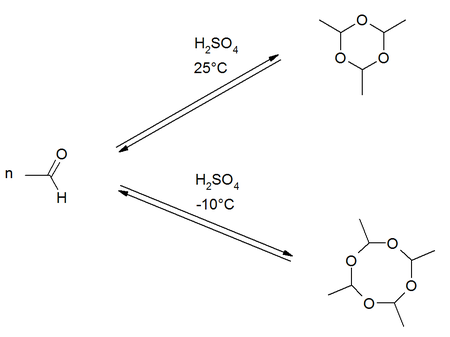
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Metaldehyd ist ein cyclischer Ether. Es ist das cyclische Tetramer des Acetaldehyds. Das Trimer wird Paraldehyd genannt. Unter der Bezeichnung Metaldehyd wird auch polymeres Acetaldehyd (CH3CHO)n vertrieben.[9] Es findet Verwendung als Trockenbrennstoff und Molluskizid, darf jedoch laut Kosmetikverordnung nicht beim Herstellen oder Behandeln von kosmetischen Mitteln verwendet werden.[2] Metaldehyd ist beispielsweise in Schneckenkorn enthalten.
Inhaltsverzeichnis
Gewinnung und Darstellung
Metaldehyd entsteht durch Cyclisierung von vier Molekülen Acetaldehyd in Gegenwart von Schwefelsäure bei niedrigen Temperaturen. Die Produktbildung der Cyclisierungsreaktion ist temperaturabhängig. Bei Raumtemperatur ist die Bildung des Trimers Paraldehyd bevorzugt. Bei niedrigeren Temperaturen um −10 °C entsteht eher das Tetramere Metaldehyd.[10]
Eigenschaften
Metaldehyd ist ein farbloser, geschmackloser, leichtentzündlicher Feststoff mit schwachem charakteristischem Eigengeruch, dessen Schmelzpunkt bei 45,5 °C liegt.[4] Die in der Literatur[3][2][9] angegebenen Schmelz- und Sublimationstemperaturen zwischen 100 °C und 250 °C beziehen sich auf polymeres Acetaldehyd und resultieren eher aus Depolymerisationsprozessen.
Wie bei Paraldehyd können auch für die Molekülstruktur von Metaldehyd mehrere Stereoisomere formuliert werden. Die Methylgruppen können jeweils axial oder äquatorial am Ring sein.
Weblinks
- WHO International Programme on Chemical Safety: Poisons Information Monograph 332 for Metaldehyd
- Institut für Veterinärpharmakologie und -toxikologie: Metaldehyd
Einzelnachweise
- ↑ Datenblatt Metaldehyd bei AlfaAesar, abgerufen am 14. April 2010 (JavaScript erforderlich).
- ↑ a b c d Enius: Metaldehyd.
- ↑ a b c d Eintrag zu CAS-Nr. 108-62-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Januar 2008 (JavaScript erforderlich).
- ↑ a b Craven et.al: J. Appl. Chem. 12 (1962) 526.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics. 85. Auflage, 2005, CRC Press, Kap. 3, S. 356.
- ↑ a b Eintrag zu CAS-Nr. 108-62-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Metaldehyde bei Sigma-Aldrich, abgerufen am 10. April 2011.
- ↑ WHO: Metaldehyde (englisch).
- ↑ a b Aldrich-Katalog Handbuch Feinchemikalien und Laborgeräte 2009/2010.
- ↑ H.P. Latscha; U. Kazmaier; H.A. Klein: Chemie für Biologen, Springer Verlag 2005, S. 515, ISBN 3-540-21161-6.
Kategorien:- Gesundheitsschädlicher Stoff
- Feuergefährlicher Stoff
- Sauerstoffhaltiger gesättigter Heterocyclus
- Acetal
Wikimedia Foundation.