- Paraldehyd
-
Strukturformel 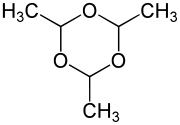
Allgemeines Freiname Paraldehyd Andere Namen - 2,4,6-Trimethyl-1,3,5-trioxan
- Paracetaldehyd
Summenformel C6H12O3 CAS-Nummer 123-63-7 PubChem 31264 ATC-Code N05CC05
Kurzbeschreibung farblose Flüssigkeit mit süßlichem Geruch [1]
Arzneistoffangaben Wirkstoffklasse Sedativum, Hypnotikum
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 132,16 g·mol−1 Dichte 0,99 g·cm−3(20 °C) [1]
Schmelzpunkt Siedepunkt 124 °C [1]
Dampfdruck Löslichkeit Brechungsindex 1,405 bei 20°C[3]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [4] 
Achtung
H- und P-Sätze H: 226 EUH: keine EUH-Sätze P: keine P-Sätze [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] keine Gefahrensymbole R- und S-Sätze R: 10 S: (2)-29 LD50 2711 mg·kg−1 (Ratte, peroral)[5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Paraldehyd ist eine chemische Verbindung. Es ist das Trimer des Acetaldehyd. Es handelt sich um ein cyclisches Vollacetal. Entsprechend ist das Molekül instabil, schon gegenüber verdünnten Säuren.
Inhaltsverzeichnis
Gewinnung und Darstellung
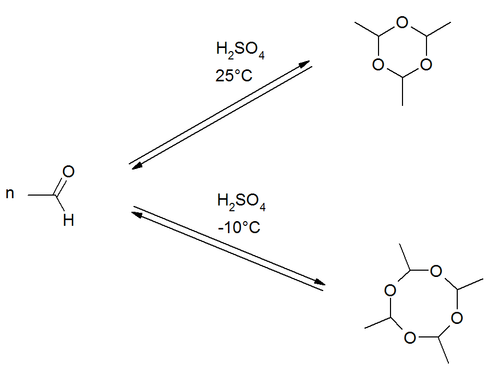
Paraldehyd entsteht durch Cyclisierung von drei Molekülen Acetaldehyd in Gegenwart von Schwefelsäure. Die Produktbildung der Cyclisierungsreaktion ist temperaturabhängig. Bei Raumtemperatur ist die Bildung des Trimers bevorzugt. Bei niedrigeren Temperaturen um −10 °C entsteht eher das Tetramere Metaldehyd.[6]
Eigenschaften
Paraldehyd ist eine klare und farblose Flüssigkeit, die mit typischen organischen Lösungsmitteln mischbar sowie in Wasser gut löslich ist. Die Löslichkeit in Wasser sinkt dabei mit steigender Temperatur.
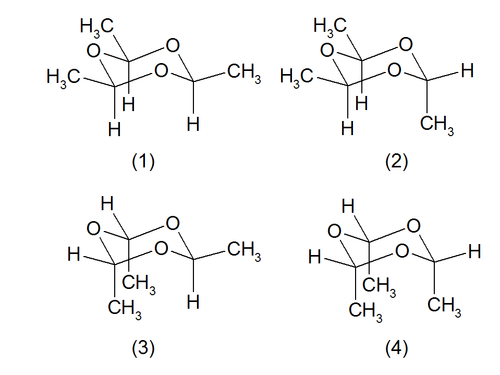
Für die Molekülstruktur können theoretisch vier Stereoisomere formuliert werden. Tatsächlich existieren nur die beiden Strukturen (1) und (2), die als cis- und trans-Paraldehyd bekannt sind. Die Strukturen (3) und (4) sind aus sterischen Gründen unwahrscheinlich, da sich hier die Methylgruppen gegenseitig behindern würden.[7][8]
Sicherheitshinweise
Die Lagerung ist auf Grund der Instabilität schwierig. Man setzt ein Antioxidans zu und lagert fern von Licht und Wärme bzw. in Braunglasflaschen. Die angebrochenen Mengen sollten möglichst klein gehalten und schnell verbraucht werden.
Nachweis
- Der Aldehyd reagiert in der Tollensprobe mit einem Silberdiamminkomplex und bildet einen Silberspiegel aus elementarem Silber.
- In der Iodoformreaktion lässt sich die CH3-CO-Gruppe nachweisen.
Für beide Reaktionen ist eine saure Hydrolyse des Paraldehyds zu Acetaldehyd erforderlich.
Paraldehyd wird in Arzneibüchern monographiert.
Siehe auch
Einzelnachweise
- ↑ a b c d e f Eintrag zu 2,4,6-Trimethyl-1,3,5-trioxan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Januar 2008 (JavaScript erforderlich)
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics. 85. Auflage, 2005, CRC Press, Kap. 3, S. 448.
- ↑ a b Datenblatt Paraldehyde bei Sigma-Aldrich, abgerufen am 18. April 2011.
- ↑ a b Eintrag zu CAS-Nr. 123-63-7 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Paraldehyd bei Merck, abgerufen am 18. Januar 2011.
- ↑ H.P. Latscha; U. Kazmaier; H.A. Klein: Chemie für Biologen, Springer Verlag 2005, S. 515, ISBN 3-540-21161-6
- ↑ Kewley, R.: Microwave spectrum of paraldehyde in Can. J. Chem. 48 (1970), 852–855
- ↑ Carpenter, D.C., Brockway, L.O.: The Electron Diffration Study of Paraldehyde in J. Amer. Chem. Soc. 58 (1936), 1270–1273
Wikimedia Foundation.