- 3-Aminopropen
-
Strukturformel 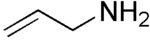
Allgemeines Name Allylamin Andere Namen - 3-Amino-1-propen (IUPAC)
- 3-Aminopropen
- 3-Aminopropylen
- 3-Aminoprop-1-en
- 2-Propenylamin
Summenformel C3H7N CAS-Nummer 107-11-9 PubChem 7853 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 57,09438 g·mol−1 Aggregatzustand flüssig
Dichte 0,76 g·cm−3[1]
Schmelzpunkt −88 °C[1]
Siedepunkt 53 °C[1]
Dampfdruck 323 mbar bei 25 °C[1]
Löslichkeit mit Wasser mischbar[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Leicht-
entzündlichGiftig Umwelt-
gefährlich(F) (T) (N) R- und S-Sätze R: 11-23/24/25-51-53 S: (1/2)-9-16-24/25-45-61 LD50 78–100 mg/kg (Ratte)[1]
WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Allylamin, auch als 3-Aminopropen, 3-Aminopropylen oder 3-Amino-1-propen bezeichnet, ist ein Amino-Derivat des Propens.
Inhaltsverzeichnis
Eigenschaften
Allylamin ist eine leichtentzündliche, mit Wasser mischbare, Flüssigkeit. Die wässrige Lösung reagiert alkalisch. Der pH-Wert einer Lösung von 5,7 g in einem Liter Wasser beträgt 11,2. Die Dämpfe des sehr leichtflüchtigen Allylamins können mit Luft explosionsfähige Gemische bilden. Allylamin, sowie einige Derivate dieser Verbindung, sind Inhibitoren des Rinder-Enzyms BPAO (bovine plasma amine oxidase) [3]
Toxizität
Dämpfe von Allylamin, aber auch flüssiges Allylamin, haben eine stark reizende Wirkung auf die Augen und Haut. Allylamin ist ein kardiovaskuläres Toxin. So löst die Gabe von Allylamin in Ratten eine zystische Medianekrose Erdheim-Gsell der Aorta[4] sowie Arteriosklerose aus.[5]
Verwendung
Allylamin ist das Basismonomer für die Synthese von Polyallylamin (PAAm beziehungsweise PAH =Polyallylamin Hydrochlorid). Die Polymerisation kann sowohl radikalisch als auch im Plasma (Plasmaunterstützte chemische Gasphasenabscheidung (PECVD)) erfolgen.[6] Allylamin ist ein Baustein zur Synthese von Terbinafin.[7] und anderen Fungiziden aus der Klasse der Allylamine.[8][9][10]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 107-11-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23.06.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 107-11-9 im European chemical Substances Information System ESIS
- ↑ H. B. Jeon, L. M. Sayre: Highly potent propargylamine and allylamine inhibitors of bovine plasma amine oxidase. In: Biochem Biophys Res Commun. 304/2003, S. 788–94. PMID 12727226
- ↑ D. Kumar u. a.: Allylamine and beta-aminopropionitrile induced aortic medial necrosis: mechanisms of synergism. In: Toxicology 125/1998, S. 107–115. PMID 9570326
- ↑ D. J. Conklin, B. J. Boor: Allylamine cardiovascular toxicity: evidence for aberrant vasoreactivity in rats. In: Toxicology and applied pharmacology 148/1998, S. 245–251. PMID 9473532
- ↑ A. Choukourov u. a.: Mechanistic studies of plasma polymerization of allylamine. In: J Phys Chem B 109/2005, S. 23086–95. PMID 16854007
- ↑ G. Petranyi u. a.: Antifungal activity of the allylamine derivative terbinafine in vitro. In: Antimicrobial Agents and Chemotherapy 31/1987, S. 1365–1368. PMID 174943
- ↑ N. S. Ryder: Specific inhibition of fungal sterol biosynthesis by SF 86-327, a new allylamine antimycotic agent. In: Antimicrob Agents Chemother 27/1985, S. 252–256. PMID 4039119
- ↑ G. Petranyi u. a.: Allylamine derivatives: new class of synthetic antifungal agents inhibiting fungal squalene epoxidase. In: Science 224/1984, S. 1239–1241. PMID 6547247
- ↑ I. Salmoiraghi u. a.: Allylamine type xanthone antimycotics. In: Arch Pharm 331/1998, S. 225–7. PMID 9713256
Literatur
- P. Nussbaumer et al.: Synthesis and structure-activity relationships of side-chain-substituted analogs of the allylamine antimycotic terbinafine lacking the central amino function. In: Journal of medicinal chemistry 38/1995, S. 1831–1836.
Wikimedia Foundation.
