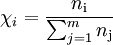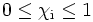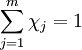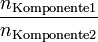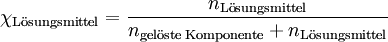- Molfraktion
-
Allgemein ist der Stoffmengenanteil (Formelzeichen: χ, oft vereinfacht x), früher auch Molenbruch, einer Komponente an einem Stoffgemisch die relative Anzahl der Teilchen (Atome/Moleküle/Ionen) dieser Komponente an der Gesamtteilchenzahl des Stoffgemisches. Er gehört somit zu den Gehaltsangaben. Dagegen bezeichnet das Stoffmengenverhältnis die relative Anzahl an Teilchen der Komponenten zueinander.
Inhaltsverzeichnis
Berechnung
Stoffmengenanteil
Berechnet wird der Stoffmengenanteil der Komponente i über den Bruch aus der Stoffmenge der Komponente i, dividiert durch die Summe aller Stoffmengen des Stoffgemisches aus m Komponenten. Dabei läuft der Zähler j über alle m Komponenten.
Der Stoffmengenanteil eines Bestandteils eines Gemisches liegt zwischen 0 und 1:
Die Stoffmengenanteile aller m Bestandteile eines Gemisches addieren sich zu 1:
Der Stoffmengenanteil ist somit ein Maß für die anteilige Teilchenzahl einer Komponente an einem Gemisch und findet vor allem in T-x-Phasendiagrammen Verwendung. Beträgt der Stoffmengenanteil 1, liegt die entsprechende Komponente in Reinform vor; beträgt er 0, ist sie nicht im Gemisch enthalten. Multipliziert man den Stoffmengenanteil mit 100 Prozent, so lässt er sich auch in Form einer prozentualen Größe, als so genannte Stoffmengenprozent oder Molprozent (Abk. Mol-%) angeben. Es ist eine dimensionslose Größe.
Da ein solches Maß vielseitig einsetzbar ist, ergeben sich aus ihm zahlreiche Anwendungsgebiete in verschiedensten Fachbereichen, vor allem der Chemie, aber auch der Mineralogie, Petrologie, Materialwissenschaft und Werkstoffkunde, um beispielsweise die Zusammensetzung von Gesteinen, Mineralien (Mischkristallen) und Legierungen zu beschreiben.Stoffmengenverhältnis
Das Stoffmengenverhältnis berechnet sich über den Bruch der Stoffmenge der einen Komponente durch die Stoffmenge der anderen Komponente.
Häufig wird das Verhältnis auch in Form einer Division dargestellt.
- nKomponente1:nKomponente2
Das Stoffmengenverhältnis wird häufig bei der Beschreibung von Reaktionsgleichungen und -anleitungen verwendet. Dabei wird das Verhältnis der Ausgangsstoffe, die bei der Reaktion eingesetzt werden, dargestellt und auf eine Ausgangssubstanz bezogen. So wird bei der Knallgasreaktion Wasserstoff mit Sauerstoff im Stoffmengenverhältnis 2:1 umgesetzt; auf Sauerstoff bezogen wird häufig die Bezeichnung 2 Äquivalente Wasserstoff verwendet. Die Bezeichnung leitet sich von dem Konzept der Äquivalentteilchen ab.
Lösungen
Für das Beispiel einer Lösung berechnet sich der jeweilige Stoffmengenanteil des Lösungsmittels bzw. der gelösten Komponenten wie folgt:
bei m gelösten Komponenten:
Bei näherungsweisen Rechnungen wird im Spezialfall vereinfacht angenommen, dass der Stoffmengenanteil der Komponente in Relation zur Lösung vernachlässigbar klein ist und man daher den Stoffmengenanteil des Lösungsmittels gleich 1 setzen kann.
Weblinks
- Substance Amount Fraction Calculator Online Substance Amount Fraction Calculator
Siehe auch
Wikimedia Foundation.