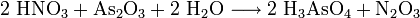- N2O3
-
Strukturformel 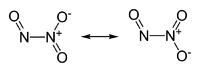
Allgemeines Name Distickstofftrioxid Summenformel N2O3 CAS-Nummer 10544-73-7 Kurzbeschreibung blassblaue Flüssigkeit (<3 °C) Eigenschaften Molare Masse 76,01 g·mol−1 Aggregatzustand instabil bei Standardbedingungen
Dichte 1,4 g·cm−3 (2 °C)
Schmelzpunkt −102 °C
Siedepunkt 3 °C
Sicherheitshinweise Gefahrstoffkennzeichnung 
unbekannt R- und S-Sätze R: ? S: ? Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Distickstofftrioxid ist eine chemische Verbindung mit der Formel N2O3 aus der Gruppe der Stickoxide. Es ist das formale Anhydrid der Salpetrigen Säure. Unterhalb von 3 °C liegt sie als blassblaue Flüssigkeit vor.
Inhaltsverzeichnis
Eigenschaften
Distickstofftrioxid ist bei Normdruck oberhalb von 3 °C instabil, da es beim Sieden in NO und NO2 dissoziert. Unterhalb von −102 °C liegt es in festem Aggregatzustand vor.
- ΔfH0gas: 91.200 kJ/mol
- S0gas, 1 bar: 314.626 J/mol·K
Herstellung
Distickstofftrioxid wird durch Kontakt gleicher Mengen Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2) erzeugt, wobei die Mischung unter −21 °C abgekühlt wird. Die beiden Gase reagieren miteinander und verbinden sich zu der blassblauen Flüssigkeit Distickstofftrioxid mit der Formel N2O3.
Eine bequeme Herstellungsmethode ist, pulverförmiges Arsentrioxid mit Salpetersäure zu versetzen:[1]
Verwendung
Distickstofftrioxid ist das Anhydrid der Salpetrigen Säure HNO2. Diese entsteht auch, wenn Distickstofftrioxid in Wasser (H2O) eingebracht wird. Sie zerfällt jedoch bei nicht zeitnaher Weiterverarbeitung zu Stickstoffmonoxid NO sowie Salpetersäure HNO3. Nitrite, die Salze der Salpetrigen Säure, werden manchmal durch Zugabe von Distickstofftrioxid zu den jeweiligen Basen hergestellt.
Sicherheitshinweise
Beim Verschlucken/Einatmen durch Zerlegung in toxische Gase giftig. Brennt auf der Haut und färbt sie durch Zersetzung in NO2 gelblich. Bei Kontakt mit dem Auge sind schwere Schädigungen die Folge.
Einzelnachweise
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 487-8.
Weblinks
- Datenblatt über Stickstoffoxide bei der Australischen Regierung
- Webelements: Compound data - dinitrogen trioxide
- Oxides of nitrogen - synthesis and uses
- Ivtantermo - dinitrogen trioxide table of values
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.