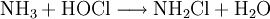- NH2Cl
-
Strukturformel 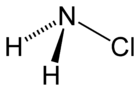
Allgemeines Name Monochloramin Andere Namen Chloramin
Summenformel NH2Cl CAS-Nummer 10599-90-3 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 51,48 g·mol−1 Schmelzpunkt ca. −70 °C (97 %, enthält NH3)[1]
Siedepunkt > −110 °C (Zersetzung)[1]
Löslichkeit löslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Monochloramin ist eine chemische Verbindung die als Desinfektionsmittel eingesetzt wird und zur Gruppe der Chloramine gehört. In reiner Form ist Monochloramin instabil und zersetzt sich bei Temperaturen von über −40 °C. In verdünnter Form ist es stabil.
Inhaltsverzeichnis
Vorkommen
Monochloramin kann durch Reaktion von Chlor mit stickstoffhaltigen Verbindungen z. B. in Schwimmbädern[3] entstehen.
Gewinnung und Darstellung
Monochloramin kann gewonnen werden durch Reaktion von Ammoniak (oder Ammoniakverbindungen) mit Hypochloriger Säure[4] unter leicht alkalischen Bedingungen:
Die Verwendung von Chlor ist weniger ratsam aufgrund der Bildung explosiven Stickstofftrichlorids als Nebenprodukt.[5]
Verwendung
Monochloramin wird in geringer Konzentration in den USA als Desinfektionsmittel in Wasserversorgungssystemen als Alternative zur Chlorierung eingesetzt. Des weiteren bildet Monochloramin ein wichtiges Zwischenprodukt bei der Hydrazin-Synthese nach dem Raschig-Verfahren.
Sicherheitshinweise
Monochloramin ist giftig für bestimmte Fischarten.
Nachweis
Monochloramin bildet mit Phenolen in Anwesenheit eines Katalysators blaue Indophenolfarbstoffe, was als Nachweis genutzt werden kann.
Quellen
- ↑ a b Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ http://www.geo.tu-freiberg.de/hydro/vorl_portal/gw-schutz/seminarvortr%E4ge/Chlorierung_von_Trinkwasser.pdf
- ↑ Fair, G. M., J. C. Morris, S. L. Chang, I. Weil, and R. P. Burden. 1948. The behavior of chlorine as a water disinfectant. J. Am. Water Works Assoc. 40:1051-1061.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 477-9.
Wikimedia Foundation.