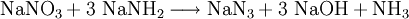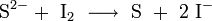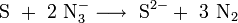- Natriumacid
-
Strukturformel 
Allgemeines Name Natriumazid Summenformel NaN3 CAS-Nummer 26628-22-8 Kurzbeschreibung farbloses Pulver Eigenschaften Molare Masse 65,01 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt nicht zutreffend
Löslichkeit mäßig in Wasser (420 g·l−1 bei 20 °C)[1] und flüssigem Ammoniak, kaum löslich in Ethanol, nicht löslich in Diethylether
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 28-32-50/53 S: (1/2)-28-45-60-61 MAK 0,2 mg·m−3[1]
LD50 27 mg/kg (Ratte, oral)[3]
WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumazid ist das Natriumsalz der Stickstoffwasserstoffsäure. Es besitzt die Formel NaN3 und gehört zur Stoffklasse der Azide.
Inhaltsverzeichnis
Darstellung
- Natriumazid entsteht beim Überleiten von Distickstoffmonoxid über Natriumamid bei 180 °C:[4][5]
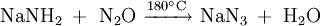
- Als Nebenprodukt entsteht nach folgender Gleichung Ammoniak:
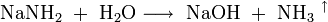
- Das Ende der Reaktion kann über die ausbleibende Entwicklung von Ammoniakgas bestimmt werden.
- Metallisches Natrium reagiert mit trockenem Ammoniak bei 350 °C zu Natriumamid (NaNH2), aus welchem beim Überleiten von trockenem Distickstoffmonoxid (N2O) bei 190 °C Natriumazid entsteht.
- In einem präparativ aufwendigeren Verfahren erhält man Natriumazid aus Natriumamid und Natriumnitrat in der Schmelze bei 175 °C. Als Nebenprodukte entstehen Natriumhydroxid und Ammoniak.
Beschreibung/Eigenschaften
In saurer Lösung zersetzt sich Natriumazid zu Stickstoffwasserstoffsäure. Beim Erhitzen zersetzt es sich ab einer Temperatur von 275 °C.
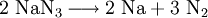 (spektralanalytisch reiner Stickstoff)
(spektralanalytisch reiner Stickstoff)
Das Azid lässt sich allerdings unzersetzt schmelzen und verpufft erst beim stärkeren Erhitzen oder auf kräftigen Schlag.
Das Azidion N3− gehört zu den Pseudohalogeniden. Es verhält sich in vielen Reaktionen ähnlich den Halogenidionen. Das mesomeriestabilisierte Ion ist linear und symmetrisch gebaut, mit einheitlichen Abständen zwischen den Stickstoffatomen. Deren Bindungslänge liegt zwischen der der N-N-Doppel- und Dreifachbindungen. Diese Stabilisierung fehlt bei der freien Säure und bei den Schwermetallaziden.
Anwendung
Natriumazid wird in der industriellen Synthese verwendet zur Darstellung von Bleiazid und Stickstoffwasserstoffsäure sowie von tert-Alkylaziden und anderen organischen Aziden wie Tosylazid (Hunnius, Römpp, Willmes) verwendet.
Die Umsetzung von Carbonylverbindungen mit Stickstoffwasserstoffsäure in stark saurem Medium liefert aus Ketonen unter Wanderung einer Alkylgruppe Amide. Werden Carbonsäuren eingesetzt, so erhält man das um ein Kohlenstoffatom ärmere Amin (Schmidt-Reaktion). Die dazu benötigte Stickstoffwasserstoffsäure wird in situ aus Natriumazid erzeugt. Eine weitere Anwendung ist die Darstellung von Alkylisocyanaten aus Carbonsäurehalogeniden (Curtius-Reaktion).
Des Weiteren wurde Natriumazid in Treibstoffen für Airbags verwendet, um den Luftsack zu füllen.[6]
Analyse
Analytisch macht man sich die Eigenschaft der Azide zunutze, mit Iod nur in Gegenwart von Thiolen beziehungsweise potentiellen Thiolverbindungen (wie Penicillin) zu reagieren (Iod-Azid-Reaktion). Diese Umsetzung ist sehr empfindlich; es entsteht Stickstoff und Iodwasserstoff. Zum Nachweis werden Iodlösung und wässrige Natriumazidlösung zusammengegeben. Dann wird die Probelösung (Mercaptane, Thioether, Disulfide, Thione, S-Heterocyclen) zugegeben. Nach kurzer Zeit entfärbt sich die Lösung unter Gasentwicklung. Es entsteht Stickstoff nach folgender Gleichung:[7]
Biologische Wirkung
Vielfältigen Einsatz findet Natriumazid auch in allen Bereichen, in denen das Wachstum von Mikroorganismen verhindert werden soll. So können mit Natriumazid Gebrauchsmaterialen (Bechergläser etc.) in Labors länger keimfrei gehalten werden. Die Chemikalie wird auch Lösungen, Dispersionen etc. zugesetzt (ca. 0,1–0,001 %), die aufgrund ihrer Zusammensetzung sehr anfällig für mikrobiellen Verderb sind (z. B. Lösungen von Biopolymeren, Proteindispersionen).
Der biochemische Wirkmechanismus besteht in der Störung der Elektronen-Transportkette der Atmungskette. Das Azid-Ion blockiert – wie auch Cyanid und Kohlenstoffmonoxid – die Sauerstoffbindungsstelle im aktiven Zentrum der Cytochrom-c-Oxidase irreversibel. Dadurch kommt die ATP-Produktion zum Erliegen und die Zelle stirbt. Die Cytochrom-c-Oxidase findet sich in den meisten sauerstoffatmenden Organismen, daher ist Azid ein recht universelles Gift – auch für Säugetiere.
Sicherheitshinweise
Aus sauren Natriumazidlösungen wird Stickstoffwasserstoffsäure freigesetzt. Diese ist sehr giftig und verätzt die Schleimhäute. Natriumazid kann wie die meisten Azide bei Erhitzung und auf Schlag explosiv reagieren. Natriumazid hemmt spezifisch Enzyme, die Schwermetalle enthalten und wirkt daher toxisch. Das Azidion hat zudem einen stark blutdrucksenkenden Effekt. Schon die Inhalation oder die orale Aufnahme kleiner Mengen (beispielsweise 1,5 ml 10 %ige Lösung) hat starke Vergiftungserscheinungen zur Folge. Stickstoffwasserstoffsäure und ihre Lösungen riechen unerträglich stechend und rufen bei Exposition Schwindel, Kopfschmerz und Hautreizung hervor. Das präparative Arbeiten mit Natriumazid und Stickstoffwasserstoffsäure-Lösungen darf nur im gut wirkenden Abzug unter Verwendung eines Schutzschildes erfolgen. Schutzbrille tragen! Die Versuchsvorschriften sind streng einzuhalten, niemals darf Stickstoffwasserstoffsäure aufkonzentriert werden (spontane Explosion möglich). Die Lösungen sind vor Gebrauch unbedingt zu titrieren.
Weblinks
- ↑ a b c d e Eintrag zu CAS-Nr. 26628-22-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21.01.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 26628-22-8 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt Carl Roth
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 205.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 474-5.
- ↑ Skript FH Köln
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 300.
Wikimedia Foundation.