- Natriumamid
-
Strukturformel 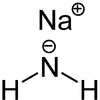
Allgemeines Name Natriumamid Summenformel NaNH2 CAS-Nummer 7782-92-5 PubChem 24533 Kurzbeschreibung grauweißer Feststoff mit ammoniakartigem Geruch[1]
Eigenschaften Molare Masse 39,01 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 400 °C[1]
Löslichkeit Zersetzung in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 


Gefahr
H- und P-Sätze H: 261-314-400 EUH: keine EUH-Sätze P: 231+232-273-280-305+351+338-310-422 [2] EU-Gefahrstoffkennzeichnung [1] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 14-19-29-34-50 S: 6-7/8-26-36/37/39-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumamid ist eine farblose, grobkristalline oder pulverige Verbindung der Zusammensetzung NaNH2.
Inhaltsverzeichnis
Darstellung
Natriumamid ist im Labormaßstab aus metallischem Natrium und flüssigem Ammoniak in Gegenwart von Eisen(III)-Ionen unter Freisetzung von Wasserstoff darstellbar.[3][4]
Ohne Eisenkatalysator wird nicht das Amid gebildet (anders als bei der analogen Synthese von Natriumhydroxid aus Natrium und Wasser), stattdessen kommt es zur Solvatisierung des 3s-Valenzelektrons des Natrium im Ammoniak. Die freien Elektronen führen zu einer tiefen Blaufärbung der Lösung, die gewissermaßen als ammoniakalische Lösung des hypothetischen „Salzes“ Na+e− aufgefasst werden. Dampft man die Lösung ein, wird Na+ wieder zum Element reduziert, die Ausbeute an NaNH2 beläuft sich so nur auf weniger als 0,5 %.
Eigenschaften
Natriumamid ist ein farbloser, hygroskopischer Feststoff.[5] Es ist eine sehr starke Base, die sich zur Deprotonierung nur schwach acider Verbindungen eignet.
Reaktionsverhalten
Mit Wasser reagiert Natriumamid heftig zu Natriumhydroxid und Ammoniak.[3]. Die Heftigkeit der Reaktion ist vergleichbar mit der von Natrium und Wasser.[5]
Durch Luftsauerstoff wird Natriumamid langsam oxidiert, wobei sich zum Teil explosive Reaktionsprodukte wie Natriumhyponitrit, Natriumtrioxodinitrat, Natriumtetraoxodinitrat sowie höhere Peroxonitrate bilden.[5] Die Oxydationsprodukte sind hochgradig reib- und schlagempfindlich. Schon einfache Mahlungs-, Zerkleinerungs- und Umfüllarbeiten können zu heftigen Explosionen führen.[5] Die Bildung von instabilen Oxydationsprodukten ist an der Verfärbung der Stoffes zu erkennen.[5] Es empfiehlt sich daher die Verbindung in einer Schutzflüssigkeit (Petroleum) aufzubewahren oder besser sofort zu verbrauchen. Alte, oxidierte Präparate sind nicht mehr brauchbar und müssen unter angemessenen Vorsichtsmaßnahmen entsorgt werden.[5]
Verwendung
Natriumamid wird in der Organischen Chemie als starke Base zur Deprotonierung wenig acider Verbindungen eingesetzt. So können zum Beispiel die stark gespannten Arine durch Umsetzung von Brombenzolderivaten mit Natriumamid durch eine E1cb-Reaktion erhalten werden. Seltener wird Natriumamid auch zur Deprotonierung von Alkoholen oder terminalen Alkinen verwendet.
So kann aus Acetylen durch Deprotonierung gewonnenes Natriumacetylid zur Alkinylierung eingesetzt werden. Da Natriumamid sterisch wenig anspruchsvoll ist, wird es auch zur Deprotonierung von sterisch schlecht zugänglichen Protonen eingesetzt.
Des Weiteren kann es zur Herstellung von Natriumazid verwendet werden.[6]Als Nukleophil fungiert es in der Tschitschibabin-Reaktion, in der es nukleophil an einem Pyridinring unter Bildung von Aminopyridinen angreift.
Literatur
K. Peter C. Vollhardt und Neil E. Schore: Organische Chemie 3. Auflage. Wiley-VCH, 2000, ISBN 3-527-29819-3.
Einzelnachweise
- ↑ a b c d e f Eintrag zu CAS-Nr. 7782-92-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28.12.2007 (JavaScript erforderlich)
- ↑ a b Datenblatt Sodium amide bei Sigma-Aldrich, abgerufen am 12. April 2011.
- ↑ a b Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-7776-0672-9, S. 204–205.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 465-8.
- ↑ a b c d e f Roth/Weller Gefährliche Chemische Reaktionen, Ergänzungslieferung 08/2007, ecomed SICHERHEIT, Verlagsgruppe Hüthig Jehle Rehm, Landsberg/Lech
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, Frank'sche Verlagshandlung, Stuttgart, 1983, 8. Auflage, S. 2728, ISBN 3-440-04513-7.
Wikimedia Foundation.




