- Arsensulfide
-
Arsensulfide sind Sulfid-Verbindungen der chemischen Elemente Arsen und Schwefel in der Form AsxSx.
Inhaltsverzeichnis
Ausbildungsformen
Es sind verschiedene Arsensulfide bekannt, von denen in der Natur insgesamt drei vorkommen:
- Tetraarsensulfid As4S, als Mineral Duranosit
- Tetraarsentrisulfid As4S3, in der Natur als Mineral Dimorphin zu finden.
- Arsen(II)-sulfid, Tetraarsentetrasulfid, As4S4, auch Arsendisulfid As2S2, in der Verhältnisformel auch mit AsS angegeben
- Ist in der Natur als Mineral Realgar (α-As4S4) und Pararealgar (γ-As4S4) bekannt. Es bildet Kristalle, von roter Farbe (in der α-Struktur, Rauschrot) bis orangegelb (γ-Struktur)
- Arsen(III)-sulfid, Tetraarsenhexasulfid As4S6 bzw. Arsentrisulfid As2S3
- Arsen(V)-sulfid, Arsenpentasulfid As2S5 kommt in der Natur nicht vor. Es ist ein zitronengelbes Pulver.
- As4S5, als Mineral Uzonit
Struktur
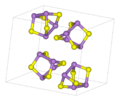
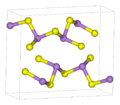
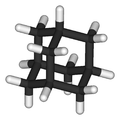
Arsensulfide haben allgemein die Summenformel As2Sn, bilden aber meist komplizierte Käfigstrukturen der Form As4Sn. Arsen ist dabei dreibindig, geht also eine Bindung mit je drei weiteren Atomen (Schwefel oder Arsen) ein. Schwefel ist zweibindig und steht brückenbildend zwischen je zwei Arsenatomen.
Arsenpentasulfid bildet die Ausnahme, da in dieser Verbindung an jedem Arsen-Atom zusätzlich noch je eine Doppelbindung zu Schwefel vorhanden ist.
Im Festkörper liegt Arsen(III)-sulfid als As2S3 in einer polymeren Struktur vor, die Käfigstruktur (hier:Adamantan-Struktur) bildet sich erst in der Gasphase.
Eigenschaften
Giftigkeit
Gefahrensymbole 

T+
Sehr giftigN
Umwelt-
gefährlichGefahrgutkennzeichnung 

Klasse 6.1
Giftiger StoffGefahrnummer 66
UN-Nummer 1557Arsensulfide sind im Allgemeinen schwer wasserlöslich und daher in reinem Zustand nicht giftig.
- an der Luft bildet sich aber meist eine geringe Menge des Arsen(III)-oxid (Arsenik).
- As2S3 (Orpiment) ist nicht löslich in Wasser und Säuren, wird also im Magen von der Salzsäure nicht abgebaut. As4S4 (Realgar) ist aber alkalisch löslich und bildet mit Säuren, sowie beide mit Kalilauge giftige Dämpfe.
- die Arsensulfide reagieren bei Verbrennung zu Arsen(III)-oxid und Schwefel bzw. Schwefeldioxid
- sowohl reines Arsen wie auch Arsen(III)-oxid als Arsenolith treten in gelben Modifikationen auf. Diese können in natürlichen Vorkommen wie auch synthetischen Produkten vorliegen
Achtung! Arsentrioxid ist eines der giftigsten Mineralien und krebserregend, und für viele Lebewesen schädlich. Die oral aufgenommene, tödliche Dosis kann für den Menschen bereits bei weniger als 0,1 g liegen. Aus diesen Gründen gelten alle Arsensulfide prinzipiell als hochgiftig und umweltschädlich und unterliegen strengsten Sicherheitsbestimmungen.
Künstliche Herstellung
Die meisten Arsensulfide können durch Zusammenschmelzen von Arsen und Schwefel im entsprechenden Mengenverhältnis gewonnen werden. Arsen(V)-sulfid entsteht aus Arsensäure und Schwefelwasserstoff.[1]
Literatur
- Holleman, Wiberg: Lehrbuch der Anorganischen Chemie, 100. Auflage, de Gruyter, 1985
- Okrusch, Matthes: Mineralogie. 7. Auflage. Springer Verlag, Berlin 2005, ISBN 3-540-23812-3
- Edition Dörfler: Mineralien Enzyklopädie. Nebel Verlag, ISBN 3-89555-076-0
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 603.
Weblinks
- Arsensulfide. In: Meyers Konversations-Lexikon. 4. Auflage. Band 1, Bibliographisches Institut, Leipzig 1885–1892, S. 875.
- Uni Freiburg - Neue Betriebsaeinfos über chemische Stoffe, Arsen und seine Verbindungen (PDF, S. 13; 603 kB)
- Energy Daily: Nanotube-Producing Bacteria Show Manufacturing Promise. (engl.)
Wikimedia Foundation.