- Oxazolidinone
-
Oxazolidinone sind Mitglieder einer Stoffgruppe gesättigter heterocyclischer Verbindungen, die in einem Fünfring sowohl ein Stickstoff-, als auch ein Sauerstoff-Atom tragen und eine Carbonyl-Gruppe enthalten. Dadurch entsteht entweder ein cyclischer Ester (ein Lacton), ein cyclisches Amid (ein Lactam), ein Keton oder ein Carbamat (Urethan). Die Stammverbindungen der Gruppe sind das 1,3-Oxazolidin und das 1,2-Oxazolidin (Isoxazolidin), von denen sich je 3 Oxazolidinone ableiten.
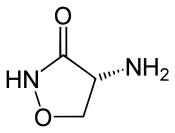
In der präparativen Chemie werden 1,3-Oxazolidin-2-one seit langem als Auxiliare eingesetzt. Einige Oxazolidinone zählen zu einer Gruppe von Antibiotika. Der erste kommerziell verfügbare Wirkstoff war Cycloserin (4-Amino-1,2-oxazolidin-3-on) als Medikament gegen Tuberkulose im Jahr 1956. Weitere Oxazolidinone sind etwa Linezolid und Eperezolid.
Auxiliare
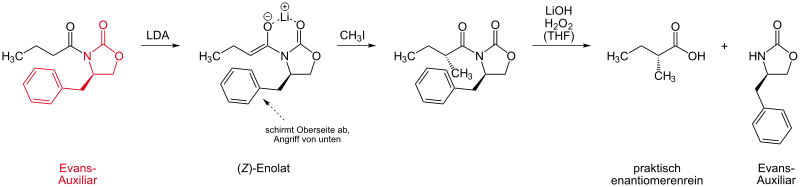
In der präparativen Chemie dienen 1,3-Oxazolidin-2-one als Auxiliare[1]. Dabei wird die umzusetzende Substanz vor der eigentlichen Reaktion mit einem Evans-Auxiliar substituiert. Das voluminöse Auxiliar lenkt die Reaktion so, dass stereoselektiv ein Reaktionsprodukt bevorzugt gebildet wird:
Nach der Reaktion muss das Evans-Auxiliar (hier mit Lithiumhydroxid und Wasserstoffperoxid) wieder abgespalten werden.
Antibiotika
Die medizinisch wirksamen Oxazolidinone gehören zu den antibakteriell wirksamen Arzneistoffen und sind sogenannte Proteinsynthese-Hemmer (genauso wie die Tetracycline, Aminoglycoside, Lincosamide und Makrolide). Oxazolidinone hemmen den Beginn der Synthese eines Peptidstranges, wo sich Ribosom, Boten- oder messenger-RNA und Start-tRNA-AS-Komplex zusammenlagern. Sie wirken meist bakteriostatisch auf Gram-positive Bakterien; Cycloserin hemmt auch Gram-negative Bakterien sowie das Mycobacterium tuberculosis.[2]
Als Nebenwirkung wurde Knochenmarksuppression beschrieben, das Blutbild sollte kontrolliert werden. In Deutschland wird Cycloserin wegen starker neurotoxischer Nebenwirkungen selbst nicht als Arzneistoff für die Arzneimittelherstellung verwendet[2], sondern in Form des Kondensationsprodukts mit Terephthaldialdehyd Terizidon, das aber ebenfalls noch neurotoxisch wirkt und daher nur als Antituberkulotikum 2. Wahl eingesetzt wird[3].
Einzelnachweise
- ↑ F. A. Carey, R. J. Sundberg, Organische Chemie, Wiley-VCH Verlag 2004 ISBN 3-527-29217-9
- ↑ a b A. W. Frahm, H. H. J. Hager, F. v. Bruchhausen, M. Albinus, H. Hager: Hagers Handbuch der pharmazeutischen Praxis: Folgeband 4: Stoffe A-K., Birkhäuser, 1999, ISBN 978-3-540-52688-9
- ↑ Mutschler, Arzneimittelwirkungen, 9. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart 2008 ISBN 978-3-8047-1952-1

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.