- Plasmidtechnik
-
 Abb. 2: Schematische Darstellung eines Plasmids mit Antibiotika-Resistenzgenen (1 & 2) und Replikationsursprung (3).
Abb. 2: Schematische Darstellung eines Plasmids mit Antibiotika-Resistenzgenen (1 & 2) und Replikationsursprung (3).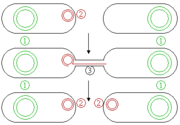 Abb. 4: Schematische Darstellung bakterieller Konjugation. (1) Chromosomale DNA. (2) Plasmide. (3) Plasmabrücke.[1]
Abb. 4: Schematische Darstellung bakterieller Konjugation. (1) Chromosomale DNA. (2) Plasmide. (3) Plasmabrücke.[1]Plasmide sind kurze, in der Regel ringförmige, autonom replizierende DNA-Moleküle, die in Bakterien, insbesondere in Archaebakterien, vorkommen können, aber nicht zum Bakterienchromosom (Kernäquivalent) zählen, somit extrachromosomal vorliegen (Abb. 1). Nur selten treten Plasmide auch in Eukaryoten auf (z. B. als 2-Mikrometer-Ring in Saccharomyces cerevisiae). Ihre Größe beträgt zwischen 1 und 25 kBp[2].
Plasmide können mehrere Gene enthalten. Vermitteln diese Gene z. B. eine Antibiotika-Resistenz, kann daraus für das Wirtsbakterium ein Selektionsvorteil resultieren. Jedes Plasmid enthält mindestens eine Sequenz, die als Replikationsursprung (engl. Origin of Replication, kurz ORI) dient. Ist der Replikationsursprung kompatibel zu dem Bakterienstamm, so kann das Plasmid unabhängig von der chromosomalen DNA repliziert werden (Abb. 2). Plasmide sind somit selbstreplizierend (replicons) und werden vererbt. Je nach Art des Replikationsursprungs liegen in einer Bakterienzelle wenige (low-copy) oder sehr viele Kopien (high-copy) vor.
Episome sind Plasmide, die sich in die chromosomale DNA des Wirtsorganismus integrieren können (Abb. 3). Dort können sie für lange Zeit verbleiben, werden dabei mit jeder Zellteilung des Wirts mit repliziert und können sogar zu einem integralen Bestandteil seiner DNA werden.
Inhaltsverzeichnis
Klassifikation
Es gibt zwei grundlegende Gruppen von Plasmiden, konjugierende und nicht-konjugierende. Konjugierende Plasmide enthalten ein so genanntes tra-Gen, das die Konjugation, den parasexuellen Austausch von Plasmiden zwischen zwei Bakterien, auslösen kann (Abb. 4). Nicht-konjugierende Plasmide haben diese Fähigkeit nicht, sie können zusammen mit konjugierenden Plasmiden während der Konjugation übertragen werden.
Verschiedene Plasmidtypen können nebeneinander in ein und derselben Zelle existieren, in Escherichia coli z. B. bis zu sieben. Sind zwei Plasmide zueinander inkompatibel, wird eines von ihnen zerstört. Abhängig von der Fähigkeit, nebeneinander in derselben Zelle zu existieren, können sie also in Inkompatiblitätsgruppen eingeteilt werden.
Die Klassifikation von Plasmiden kann durch ihre Funktion erfolgen. Es werden fünf Hauptklassen unterschieden:
- Fruchtbarkeits-(F-)Plasmide (siehe F-Plasmid), die nur tra-Gene enthalten. Ihre einzige Funktion ist die Einleitung der Konjugation.
- Resistenz-(R-)Plasmide, die Resistenzgene gegen Antibiotika oder Gifte enthalten.
- Col-Plasmide, die Gene enthalten, die für Colicine (Proteine, die für andere Bakterien toxisch sind) kodieren.
- Degradations-Plasmide, die den Abbau von ungewöhnlichen Substanzen, wie z. B. von Toluol oder Salicylsäure ermöglichen.
- Virulenz-Plasmide, die ein Bakterium zu einem Krankheitserreger machen.
Eine besondere Art von Plasmiden stellen die sog. Ti-Plasmide (Tumor inducing) dar. Sie sind oft ein Bestandteil von bestimmten Bakterien (Agrobacterium tumefaciens oder Agrobacterium rhizogenes) und werden von diesen in Pflanzen übertragen. Dort verursachen sie die einzige bekannte Krebserkrankung in Pflanzen.
Verwendung
Plasmide sind wichtige Werkzeuge der Molekularbiologie, Genetik, Biochemie und anderer biologischer und medizinischer Bereiche. Sie werden dann als Vektoren bezeichnet und dazu benutzt, um Gene zu vervielfältigen oder zu exprimieren.
Viele der für diese Zwecke eingesetzten Plasmide sind kommerziell erhältlich. Sie leiten sich von den natürlich vorkommenden Plasmiden ab und besitzen noch deren strukturelle Bestandteile wie den Replikationsursprung (Origin of Replication, ORI). Außerdem wurden sie so verändert, dass sie leicht für Klonierungen verwendet werden können (sie enthalten dafür eine so genannte MCS (Multiple Cloning Site), welche Erkennungssequenzen für eine Vielzahl von Restriktionsenzymen enthält): Das zu vervielfältigende Gen wird in Plasmide eingefügt, die über ein Gen mit einer Antibiotika-Resistenz verfügen. Dann werden diese Plasmide in Bakterien eingebracht, die auf einem mit dem entsprechenden Antibiotikum behandelten Nährmedium wachsen. Es werden also nur die Bakterien überleben, die das Plasmid mit der Information für die Antibiotika-Resistenz aufgenommen haben. Bakterien, die das Plasmid nicht aufgenommen haben, sterben durch das Antibiotikum ab. So wirkt das Antibiotikum als Selektionsmarker, der nur die Bakterien mit dem Resistenzplasmid überleben lässt. Meist wird durch das Einfügen des Gens in das Plasmid ein anderes Gen (Reportergen) unterbrochen, welches dann nicht mehr exprimiert werden kann. Diese fehlende Eigenschaft kann zum Screening genutzt werden, weil nur solche Bakterien, welche ein Plasmid mit dem gewünschten Gen aufgenommen haben, diese Eigenschaft nicht mehr besitzen. Bringt man Gene in Plasmide ein, welche dafür sorgen, dass die eingebrachten Gene in großer Menge exprimiert werden (Expressionsplasmide), kann man die entsprechenden Genprodukte in großen Mengen gewinnen. Diese Vorgehensweise erlaubt heute die Herstellung von rekombinantem Insulin (also dem Humaninsulin identischen Insulin), welches früher aufwendig aus Bauchspeicheldrüsen von Schweinen isoliert werden musste.
Soll ein DNA-Abschnitt in einen Organismus (Bakterium, Pflanze, Tier, Mensch etc.) eingebracht werden, können ebenfalls Plasmide als Überträger verwendet werden. Bei Tier und Mensch ist dieses Verfahren nur bei Zellen in Zellkultur wirklich etabliert, da dort die Zellen als Monolage gut zugänglich sind. Je nach Zelltyp benötigt man für den Transfer entweder gefällte DNA (Muskelzellen durch Endocytose) oder in Liposomen verpackte DNA. Es existieren weitere Methoden wie Elektroporation, welche die Transfektionseffizienz weiter erhöhen können.
Visualisierung
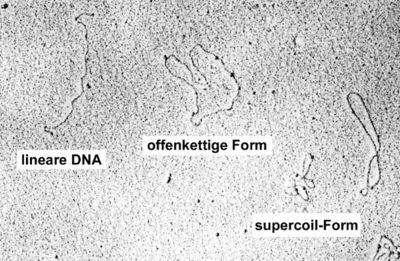
Plasmide kann man durch geeignete Verfahren im Elektronenmikroskop sichtbar machen, etwa durch Färbung mit Uran-Atomen (BAC-Spreitung). Die Ringstruktur des Plasmids in Form einer um sich selbst gewundenen DNA hat dabei topologische Konsequenzen. Die Plasmide können in drei verschiedenen Gestaltformen vorliegen. Die Supercoil-Form ist die natürliche Konformation des Plasmides. Da die DNA-Doppelhelix um sich selbst gewunden ist und sich in einem geschlossenen Plasmid nicht entwinden kann, entsteht eine Torsionsspannung, wodurch sich das Plasmid im Raum um sich selbst krümmt. Der gleiche Effekt ist bei Telefonschnüren zu beobachten, die sich um ihre eigene Achse festwinden. Bei der offenkettigen Form ist einer der beiden DNA-Stränge an einer Stelle gebrochen wodurch sich der offene Strang frei um den fixierten drehen kann, dadurch entspannt sich die Torsionspannung, das Plasmid liegt offen vor. Bei der linearen DNA sind beide Stränge gebrochen, die Kreisstruktur ist aufgehoben.
Anmerkungen
- ↑ Der DNA-Transfer erfolgt über eine Plasmabrücke. Für die Anheftung und Annäherung der Bakterien dient der Pilus, eine kurze, filamentöse Struktur.
- ↑ Plasmid-DNA ist doppelsträngig, ihre Länge wird daher in komplementären Bausteinen oder Basenpaaren gemessen.
Siehe auch
- Gentechnik
- die Plasmide pBR322 und pUC19
- Plasmidpräparation
Weblinks
- www.accessexcellence.org/AB/GG/plasmid.html – Cloning into a Plasmid
- www.accessexcellence.org/AB/GG/inserting.html – Inserting a DNA Sample into a Plasmid
Wikimedia Foundation.

_svg.png)