- Platin(II)-oxid
-
Kristallstruktur 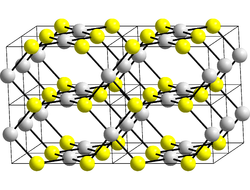
__ Pt2+ __ O2− Allgemeines Name Platin(II)-oxid Andere Namen Platinmonoxid
Verhältnisformel PtO CAS-Nummer 12035-82-4 PubChem 82844 Kurzbeschreibung schwarzer bis violetter Feststoff[1]
Eigenschaften Molare Masse 211,08 g·mol−1 Aggregatzustand fest
Dichte 14,9 g·cm−3[2]
Schmelzpunkt Löslichkeit - unlöslich in Wasser und Ethanol[2]
- löslich in Königswasser[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Platin(II)-oxid (auch Platinmonoxid) ist eines von mehreren Oxiden des chemischen Elementes Platin. Daneben existieren noch Platin(IV)-oxid und Platin(VI)-oxid.
Inhaltsverzeichnis
Gewinnung und Darstellung
Platin(II)-oxid lässt sich durch Erhitzen von Platin auf 430 °C in einer Sauerstoff-Atmosphäre mit erhöhten O2-Druck gewinnen. Platin(IV)-oxid zerfällt ab 400 °C zu Platin(II)-oxid und Sauerstoff.
Es kann auch durch vorsichtiges Erhitzen von Platin(II)-hydroxid unter Abspaltung von Wasser gewonnen werden:[2]
Eigenschaften
Platin(II)-oxid kristallisiert wie Palladium(II)-oxid nicht in einer Natriumchlorid-, sondern in einer Platinsulfid-Struktur. In dieser liegen kantenverknüpfte Quadrate einer PtO4-Struktur vor. Daneben sind die Platin- und Sauerstoffatome in Bändern angeordnet.
Mit Ausnahme von Königswasser ist Platin(II)-oxid in Säuren unlöslich. Als starkes Oxidationsmittel wird es auch von schwachen Reduktionsmitteln wie Wasserstoff bei Raumtemperatur zum Element reduziert.
Das durch Reaktion von Platin(II)-lösungen mit Natronlauge gebildete Platinmonoxid-hydrat lässt sich nicht ohne Sauerstoffabgabe zu Platin(II)-oxid dehydratisieren. Versucht man es unter Anwesenheit von Sauerstoff zu entwässern, bildet sich stattdessen ein Platin(III)-oxid-hydrat.
Einzelnachweise
- ↑ Datenblatt bei Webelements
- ↑ a b c d e Simon Cotton: Chemistry of Precious Metals, 1997, S. 725.
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1732.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1732–1734.
Kategorien:- Platinverbindung
- Oxid
Wikimedia Foundation.

