- Protocatechualdehyd
-
Strukturformel 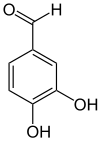
Allgemeines Name Protocatechualdehyd Andere Namen 3,4-Dihydroxybenzaldehyd
Summenformel C7H6O3 CAS-Nummer 139-85-5 PubChem 8768 Kurzbeschreibung beigefarbener Feststoff[1]
Eigenschaften Molare Masse 138,12 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit schlecht in Wasser (6,3 g·l−1 bei 20 °C)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [1] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Protocatechualdehyd (3,4-Dihydroxybenzaldehyd) ist ein aromatischer Aldehyd. Er kommt glykosidisch gebunden in der Vanille vor. Er entsteht auch bei der Zersetzung des Aromastoffs Piperonal (= „Methylen-protocatechualdehyd“) durch die Einwirkung von Luftsauerstoff, Licht und Wärme. Der Stoff ist ein Zwischenprodukt bei der Darstellung der Stoffe Vanillin, Ethylvanillin und Piperonal sowie des Überträgerstoffs (Neurotransmitters) Dopamin. Protocatechualdehyd kann enzymatisch zur Protocatechusäure oxidiert werden.[3]
Inhaltsverzeichnis
Gewinnung und Darstellung
Der Protocatechualdehyd kann aus Brenzcatechin, aus Piperonal sowie durch Demethylierung von Vanillin hergestellt werden.[4] Während früher die Herstellung aus Piperonal der übliche Zugang war, bietet sich heute vor allem die Darstellung aus Vanillin an:
- Kochen von Vanillin mit verdünnter Salzsäure.[5]
- Kochen von Vanillin mit wasserfreiem Aluminiumchlorid und Pyridin.[6]
- Umsetzung von Vanillin mit wasserfreiem Aluminiumbromid und Nitrobenzol.[7]
- Umsetzung von Vanillin mit quecksilber-aktiviertem Aluminium und elementarem Brom in Nitrobenzol.[8]
Einzelnachweise
- ↑ a b c d Datenblatt 3,4-Dihydroxybenzaldehyde bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ a b Datenblatt Protocatechualdehyd bei Merck, abgerufen am 13. März 2010.
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: "Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices", in: Cell. Physiol. Biochem., 2005, 15 (1–4), S. 89–98; PMID 15665519; PDF.
- ↑ Chemikalienlexikon
- ↑ Karl Hell, Carl Haussermann: Neues Handwörterbuch der Chemie, 784 (1875).
- ↑ Robert G. Lange: "Cleavage of Alkyl o-Hydroxyphenyl Ethers", in: J. Org. Chem., 1962, 27 (6), S. 2037–2039; doi:10.1021/jo01053a030.
- ↑ A. Pearl, D. L. Beyer: "Reactions of Vanillin and its Derived Compounds. XXII. Ethers of Protocatechuic Acid and their Ethyl Esters", in: J. Am. Chem. Soc., 1953, 75 (11), S. 2630–2633; doi:10.1021/ja01107a022.
- ↑ US Patent US2975214.
Weblinks
Siehe auch
Wikimedia Foundation.
