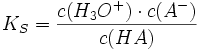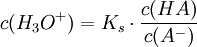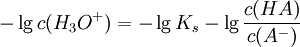- Pufferlösung
-
Ein Puffer ist ein Stoffgemisch, dessen pH-Wert (Konzentration der Oxoniumionen) sich bei Zugabe einer Säure oder einer Base wesentlich weniger stark ändert, als dies in einem ungepufferten System der Fall wäre. Die Wirkung des Puffers beruht auf der Umsetzung der durch die Säure bzw. Base zugeführten Oxoniumionen (H3O+) bzw. der Hydroxidionen (OH−) zu schwachen Säuren bzw. Basen, die selbst nur wenig zur Bildung von H3O+ bzw. OH−−Ionen neigen.
Puffer sind die in der Chemie gezielt hergestellte, wässrige Pufferlösungen. Komplexere Puffersysteme liegen in Körperflüssigkeiten wie dem Blut, oder auch in Grundwässern, die beispielsweise mit Humus in Wechselwirkung stehen, vor.
Inhaltsverzeichnis
Chemische Grundlagen einer Pufferlösung
 Gleichgewichtslagen eines Puffersystems einer schwachen Säure HA mit Ks = 10−5 und ihrer konjugierten Base A− in Abhängigkeit vom pH-Wert der Lösung. Der Verlauf der Kurve wird durch die Henderson-Hasselbalch-Gleichung beschrieben. Liegen HA und A− in gleichen Konzentrationen vor, ist der pH-Wert gleich dem pKs-Wert. Der Pufferbereich der Lösung (__) liegt dann in einem pH-Bereich von ±1.
Gleichgewichtslagen eines Puffersystems einer schwachen Säure HA mit Ks = 10−5 und ihrer konjugierten Base A− in Abhängigkeit vom pH-Wert der Lösung. Der Verlauf der Kurve wird durch die Henderson-Hasselbalch-Gleichung beschrieben. Liegen HA und A− in gleichen Konzentrationen vor, ist der pH-Wert gleich dem pKs-Wert. Der Pufferbereich der Lösung (__) liegt dann in einem pH-Bereich von ±1.Pufferlösungen enthalten eine Mischung aus einer schwachen Säure und ihrer konjugierten Base (oder des jeweiligen Salzes). Auch Ampholyte (bifunktionale Moleküle) können als Puffer dienen. Der den pH-Wert bestimmende Faktor ist das Verhältnis bzw. das Protolyse-Gleichgewicht des Pufferpaares.
Für das Säure-Base-Gleichgewicht einer schwachen Säure HA gilt:
Nach dem Massenwirkungsgesetz stünde im Nenner zusätzlich noch die Konzentration des Wassers. Diese kann jedoch, da sie im Vergleich zu den Ionenkonzentrationen mit 55,6 mol/l sehr groß ist, als konstant angesehen werden und wird definitionsgemäß in die Dissoziationskonstante Ks (der Säurekonstante) hineingezogen.
Durch Umformen erhält man:
Bildet man hieraus den negativen dekadischen Logarithmus, erhält man:
Dies entspricht:
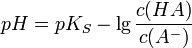
- Henderson-Hasselbalch-Gleichung (Puffergleichung)
Mit dieser Gleichung – sie gilt unter der Näherung, dass die Aktivitäten der Stoffe ihren Konzentrationen in Lösung entsprechen – lässt sich bei bekanntem pKs-Wert für einen bestimmten pH-Wert das Konzentrationsverhältnis an Säure und Base ermitteln. Je höher die Konzentrationen sind, desto geringer wirken sich Zugaben von Säuren oder Basen aus. Die Menge an starker Base (oder Säure), die durch eine Pufferlösung ohne wesentliche Änderung des pH-Wertes aufgenommen werden kann, wird durch die Pufferkapazität ausgedrückt.
Beispiele für Pufferlösungen sind der Essigsäure/Acetat-Puffer oder der Ammoniumpuffer aus Ammoniumionen und Ammoniak.
Arten von Puffersystemen
Der Carbonatpuffer (eine Mischung aus Kohlensäure und Hydrogencarbonaten) ist ein Teil des Blutpuffers. Dieser hält den pH-Wert des Blutes zwischen pH 7,35 und 7,45 und gleicht die durch den Stoffwechsel verursachten Schwankungen aus. Bei einem pH-Wert unterhalb von unter 7,35 spricht man von einer Azidose, über 7,45 von einer Alkalose. Der Tod tritt bei pH-Werten unter 6,8 bzw. über 8,0 ein.
Betrachtet man ein Puffersystem, so muss zwischen geschlossenen und offenen Puffersystemen unterschieden werden. Bei einem geschlossenen Puffersystem (z. B. Essigsäure/Acetat-Puffer) werden die bei einer chemischen Reaktion entstehenden Protonen (H+) oder Hydroxid-Ionen (OH−) von der Puffersubstanz abgefangen. Sie reagieren zu der entsprechenden konjugierten Säure oder Base des Puffers und verbleiben demnach in der Lösung. Bei einem offenen Puffersystem (z. B. dem Bicarbonat/CO2-Puffersystem in der Lunge) steht das System im Austausch mit der Umgebung. Es ist in der Lage durch Abgabe einer Komponente an die Umgebung den entsprechenden pH-Wert aufrecht zu erhalten, z. B. durch Abatmen von CO2.
Bedeutung von Puffersystemen
Puffersysteme haben eine wichtige Bedeutung in der technischen Chemie wie beispielsweise bei der Galvanisierung, Herstellung von Farbstoffen oder in der Fotografie, genauso wie in der Analytik.
Auch spielen Puffersysteme in der Bodenkunde eine wichtige Rolle; siehe hierzu Pufferbereich (Bodenkunde).
Bedeutung in den Biowissenschaften: Für viele Tiere und nicht zuletzt auch für den menschlichen Organismus sind Puffer unerlässlich. So sind die menschlichen Blutkörperchen und viele Enzyme auf einen konstanten pH-Wert angewiesen. Ohne Puffer würden bereits kleinste Mengen Säure – z. B. Laktat aus dem Energiestoffwechsel – genügen, um den Organismus lahm zu legen, weil diverse Proteine denaturieren und somit unbrauchbar werden würden.
Einige Pufferbeispiele
- Kohlensäure/Bicarbonat-System (pH 6,2 bis 8,6; neutral)
- Kohlensäure-Silicat-Puffer (pH 5,0 bis 6,2; schwach sauer)
- Aluminium-Pufferbereich
- Eisen-Pufferbereich (pH < 3,0; extrem sauer)
- Essigsäure/Acetat-Puffer (pH 3,7 bis 5,7)
- Phosphatpuffer KH2PO4 + Na2HPO4 (pH 5,4 bis 7,8)
- Veronal/Acetat-Puffer nach Michaelis (pH 2,6 bis 9,2)
- Ammoniakpuffer NH3 + H2O + NH4Cl (pH 8,2 bis 10,2)
- Eichlösung für pH-Messgeräte
- HEPES (4-(2-Hydroxyethyl)-1-piperazinethanesulfonsäure) (pH 6,8 bis 8,2)
- PBS-Puffer (pH 7,4)
- MES (2-(N-Morpholino)ethansulfonsäure) (pH 5,2 bis 6,7)
Siehe auch
Weblinks
Wikimedia Foundation.