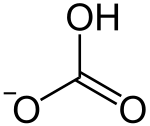
- Hydrogencarbonate
-
Hydrogencarbonate, veraltet auch Bicarbonate oder saure Carbonate, sind die Salze der Kohlensäure, die durch einfache Neutralisation dieser Säure mit einer Base entstehen. Oft wird auch das Anion dieser Salze, das Hydrogencarbonat-Ion (HCO3−) verkürzt als Hydrogencarbonat bezeichnet. Wird durch weitere Basen-Zugabe auch die zweite Säurefunktion (Carboxygruppe) neutralisiert, so erhält man Carbonate.
Infolge dessen haben gelöste Bicarbonat-Ionen aufgrund ihres Potenzials sowohl jeweils ein Proton abzugeben (Protonendonator) als auch wieder aufzunehmen (Protonenakzeptor) eine wichtige physiologische Bedeutung als Bestandteil des Kohlensäure-Bicarbonat-Systems und somit kapazitativ größter Anteil der Blutpuffer-Systeme bei der Regulation des Säure-Basen-Haushaltes von Säugetier-Organismen.
Wichtige Hydrogencarbonate sind das Natriumhydrogencarbonat (Natron, Bullrich-Salz – NaHCO3), das Ammoniumhydrogencarbonat (Hirschhornsalz – NH4HCO3) und das Calciumhydrogencarbonat („Carbonathärte“ des Wassers).
Inhaltsverzeichnis
Eigenschaften von Hydrogencarbonaten
Der Aggregatzustand ist wie bei Carbonaten fest, weil zwischen den Hydrogencarbonat-Ionen und Kationen Ionenbindungen vorliegen und sich dadurch regelmäßige Ionengitter formieren. Hydrogencarbonate sind farblos und erscheinen in Pulverform weiß, soweit nicht das Kation eine Farbe einbringt. Hydrogencarbonate sind geruchlose Stoffe. Die meist löslichen Hydrogencarbonate bilden mit Wasser elektrisch leitfähige Lösungen, weil sie neben den Kationen frei bewegliche, hydratisierte Hydrogencarbonat-Anionen bilden. Hydrogencarbonat ist amphoter.
Zersetzung: Oberhalb einer Temperatur von 50 °C zerfällt Hydrogencarbonat; unter anderem entstehen Wasser und Kohlenstoffdioxid.
Die Hydrogencarbonate der Erdalkalimetalle (Calcium, Magnesium, Barium, Strontium) sind zwar in Wasser gut löslich, stehen aber über das Dissoziationsgleichgewicht der Kohlensäure in Beziehung zu den entsprechenden Carbonaten, die durchweg schwer löslich sind. Um das Löslichkeitsprodukt der Carbonate nicht zu überschreiten, muss der pH-Wert hinreichend niedrig sein, was durch die Anwesenheit einer Mindestkonzentration an freier Kohlensäure, somit an gelösten Kohlendioxid, gewährleistet ist. Diese bezeichnet man als zugehörige Kohlensäure. Entweicht sie aus dem Wasser oder wird sie in Seen durch Photosynthese verbraucht, so beginnen sich die Carbonate in kristalliner Form abzuscheiden (Kesselstein, Seekreide)
Es ist folglich (unter normalen Bedingungen) nicht möglich, die Hydrogencarbonate der Erdalkalien als Feststoff herzustellen. Beim Einengen der Lösungen werden immer die Carbonate gebildet.
Reaktionen von Hydrogencarbonaten

- Natriumhydrogencarbonat und Calcium reagieren zu Calciumcarbonat, Natriumcarbonat und Wasserstoff
Vorkommen und Verwendung von Natriumhydrogencarbonat
Natriumhydrogencarbonat kommt als Mineral (Nahcolith) in den USA vor. Es findet in der Lebensmitteltechnik z. B. als Back- und Brausepulver Verwendung. In der Medizin wird es gegen Sodbrennen eingesetzt („Bullrichsalz“®). Natriumhydrogencarbonat ist auch Bestandteil von Feuerlöschpulver.
Herstellung von Natriumhydrogencarbonat

- Natriumcarbonat, Kohlenstoffdioxid und Wasser reagieren zu Natriumhydrogencarbonat.
Diese Reaktion muss unter Kühlung ablaufen.
Verwendung von Ammoniumhydrogencarbonat
Hirschhornsalz wird beim Backen von Lebkuchen verwendet und zerfällt zu Ammoniak (NH3), Wasser und Kohlendioxid. Das im Handel erhältliche Salz besteht zumeist aus einer Mischung von Ammoniumhydrogencarbonat, Ammoniumcarbonat und Ammoniumcarbaminat.
Wikimedia Foundation.