- Pyrolytisches Bornitrid
-
Strukturformel 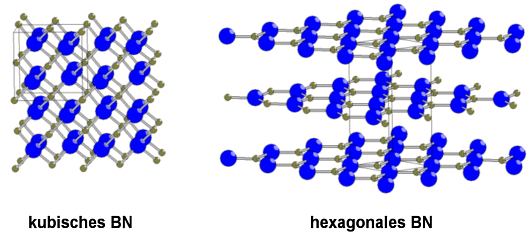
Allgemeines Name Bornitrid Summenformel BN CAS-Nummer 10043-11-5 Kurzbeschreibung weißer, geruchloser Feststoff Eigenschaften Molare Masse 24,83 g·mol−1 Aggregatzustand fest
Dichte 2,25 g·cm−3 (α-BN)(hexagonal)[1]
3,45 g·cm−3 (β-BN)(kubisch)[1]Schmelzpunkt 2700 °C[2]
Löslichkeit unlöslich in Wasser[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bornitrid, chemische Formel BN, ist eine Bor-Stickstoff-Verbindung, die in drei Modifikationen(α,β,γ) vorkommt, von denen jedoch nur zwei - α und β - stabil sind. Analog zu den allotropen (und zu Bornitrid isoelektronischen) Kohlenstoffformen Graphit und Diamant lassen sich diese drei Sorten jeweils einer Kohlenstoffmodifikation zuordnen. Entsprechend ist auch Bornitrid ein Hochpolymer.
α-BN lässt sich dem Graphit zuordnen. Es besteht ebenfalls aus Schichten einer planaren, hexagonalen Wabenstruktur, bei der die B- und N-Atome jeweils abwechselnd vorkommen. Im Gegensatz zum Graphit sind die Hexagone der einzelnen Schichten in Deckung angeordnet, so dass unterhalb und oberhalb eines jeden B-Atoms je ein N-Atom zu finden ist (und umgekehrt). Die physikalischen Eigenschaften von α-BN und Graphit sind sich sehr ähnlich. Ihre Dichten sind praktisch identisch und beide haben einen sehr hohen Schmelzpunkt. Zudem fühlen sie sich auf der Haut beim Zerreiben talkähnlich an. Hinsichtlich der elektrischen Leitfähigkeit gibt es dennoch einen Unterschied. α-BN leitet erst bei sehr hohen Temperaturen den Strom. Vorher befinden sich die pπ pπ -Rückbindungselektronen aufgrund der EN-Differenz vorzugsweise beim Stickstoff. Die π-Elektronen sind somit nicht freibeweglich und eine Stromübertragung ist nicht möglich.
Das kubische β-Bornitrid liegt in der kubischen Diamantstruktur vor. Die γ-Form hingegen entspricht der hexagonalen Diamantstruktur. Sie ist jedoch bezüglich der β-Form metastabil. Die um über 50% erhöhte Dichte der diamantanalogen Formen des Bornitrids lässt sich im Vergleich zur graphitanalogen α-Form dadurch erklären, dass sich der Schichtabstand um ca. 30% verringert.
Das kubische Bornitrid (c-BN) wurde 1957 erstmals synthetisiert. Es ist nach dem Diamant der härteste bekannte Werkstoff.[3] General Electric begann dann unter dem Warenzeichen Borazon mit der Vermarktung. Die kommerzielle Produktion von c-BN hat sich erst seit den frühen 1990er Jahren etabliert.
Inhaltsverzeichnis
Herstellung
Zur Herstellung von hexagonalem Bornitrid kann Boroxid B2O3 mit elementarem Stickstoff N2 umgesetzt werden, die Reaktion wird bei hohen Temperaturen unter Katalyse von Calciumphosphat Ca3(PO4)2 durchgeführt. Anstelle von Stickstoff kann auch Ammoniak NH3 oder eine Ammoniumverbindung eingesetzt werden. Dabei entsteht die (farblose) α-Modifikation. Analog zu Diamant aus Graphit lässt sich β-BN unter hohen Temperaturen ( 1500-2200°C) und hohem Druck ( 50-90kbar) aus α-BN herstellen. Als Katalysator kann man hierbei Li3N verwenden Bei niedrigeren Temperaturen entsteht aus α-BN statt der β-Form die γ-Form, welche jedoch bezüglich β-BN metastabil ist.
Pyrolytisches Bornitrid
Dem β-Bornitrid sehr verwandt ist das pyrolytische Bornitrid, das mit pBN oder PBN abgekürzt wird. Wegen der geringen Ausgasung auch bei hohen Temperaturen werden Tiegel aus pBN als Effusionszellen in der Molekularstrahlepitaxie eingesetzt.
Sonstige Verwendung
Technisch bedeutend ist β-Bornitrid (CBN) vor allem als Schleifmittel und als Schneidstoff für Wendeschneidplatten zur Bearbeitung von Stahl, da es – im Gegensatz zum Diamanten – unter Temperatureinwirkung keinen Kohlenstoff an Stahl abgeben kann (Carbide). Aus demselben Grund wird es auch zur Oberflächenbeschichtung eingesetzt. Es kristallisiert in der diamantähnlichen Zinkblende-Struktur. Bornitrid ist zwar etwas weniger hart als Diamant, seine Härte nimmt jedoch bei steigender Temperatur nicht so schnell ab, so dass Diamant unter Hitzeeinwirkung mit Bornitrid geschliffen werden kann. Unter Normalbedingungen weist Bornitrid eine Härte von ca. 48 Gigapascal auf (Diamant zwischen 70 und 100 Gigapascal).
Die graphitähnliche hexagonale Modifikation des Bornitrids (α-Bornitrid) wird als Schmiermittel eingesetzt („anorganischer“ oder „weißer Graphit“). Im Gegensatz zu Graphit bleibt der Reibungskoeffizient von hexagonalem Bornitrid bis über 1000 °C stabil, weshalb es als Hochtemperaturfestschmierstoff unter Vakuum sehr gut geeignet ist. Bei hoher Temperatur (1400–1800 °C) und hohem Druck (>6 GPa) wandelt sich die hexagonale in die kubische Modifikation um, analog zur Umwandlung von Graphit in Diamant. Beide Bornitrid-Modifikationen sind weiß und leiten bei niedrigen und moderaten Temperaturen keinen Strom.
Einzelnachweise
- ↑ a b Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ a b c Sicherheitsdatenblatt (alfa-aesar)
- ↑ Borazon-CNB
Wikimedia Foundation.
