- Graphit
-
Graphit Sehr reiner Graphit aus dem ehemaligen Ceylon, heute Sri Lanka Chemische Formel C Mineralklasse Elemente – Halbmetalle, Nichtmetalle
I/B.02-10 (nach Strunz)
01.03.06.02 (nach Dana)Kristallsystem hexagonal Kristallklasse dihexagonal-dipyramidal 
Farbe grau bis schwarz Strichfarbe grauschwarz Mohshärte 1 bis 2 Dichte (g/cm3) 2,1 bis 2,3, beim idealen Einkristall 2,26 [1] Glanz Metallglanz, matt Transparenz undurchsichtig Bruch uneben, biegsam Spaltbarkeit vollkommen, Schichtabstand 0,335 nm beim idealen Einkristall [1] Habitus hexagonale, tafelige, schuppige, stegelige, Kristalle; massige, körnige Aggregate Häufige Kristallflächen {001} Kristalloptik Brechungsindex n=1,93-2,07 (rot) Doppelbrechung
(optische Orientierung); einachsig negativ Pleochroismus stark rot Weitere Eigenschaften Phasenumwandlungen plast. verformbar bei >2500 °C[2] Schmelzpunkt keiner, sublimiert unter Normaldruck bei ca. 3750 °C[2] Chemisches Verhalten unlöslich in Säuren Ähnliche Minerale Molybdänit (Molybdänglanz) Magnetismus diamagnetisch Besondere Kennzeichen hohe Anisotropie (z. B. Härte, Leitfähigkeit) Graphit ist ein sehr häufig vorkommendes Mineral aus der Mineralklasse der „Elemente“. Es ist eine der natürlichen Erscheinungsformen des chemischen Elements Kohlenstoff in Reinform. Es kristallisiert meist im hexagonalen, sehr selten auch im trigonalen Kristallsystem.
Graphit entwickelt undurchsichtige, graue bis schwarze Kristalle in sechseckiger, tafeliger, schuppiger oder stegeliger Form, die auf den Kristallflächen Metallglanz aufweisen. Massige oder körnige Aggregate sind dagegen matt. Seine Mohshärte beträgt zwischen 1 und 2, seine Dichte etwa 2,1 bis 2,3, und er hat eine grauschwarze Strichfarbe.
Inhaltsverzeichnis
Besondere Eigenschaften
Graphit sublimiert in einer sauerstofffreien Umgebung bei einer Temperatur von 3825 °C. Unter Sauerstoffeinwirkung entzündet sich Graphit bei etwa 600 °C[3]. Er löst sich durch Säuren nicht auf und ist diamagnetisch. Auffällig ist das starke anisotrope Verhalten von Graphit insbesondere der Härte und der elektrischen Leitfähigkeit.
Etymologie und Geschichte
Der Name leitet sich aus dem Griechischen γραφειν (graphein) ab, was schreiben bedeutet. Er spielt damit auf die Tatsache an, dass Graphit auf Papier oder anderen rauen Oberflächen durch Abreibung der einzelnen Blättchen leicht eine graue Ablagerung hinterlässt, die im Bleistift ihre Anwendung findet.
Die Verwendung von Graphit kann in der prähistorischen Zeit auf eine lange Tradition in Europa zurückblicken. Die ersten Hinweise einer Verwendung kennt man aus dem Mesolithikum Norditaliens. Rohgraphitstücke wurden als Färbemittel benutzt und den Toten in die Gräber mitgegeben. Für das Neolithikum finden wir in Böhmen zahlreiche Belege von Graphitton – und graphitierter Keramik. Für Bayern ist in der Frühbronzezeit vor allem die Straubinger Kultur von Bedeutung, die durch starken Graphitgebrauch auffällt. In der späten Eisenzeit in Mitteleuropa (Latènezeit) wurde Graphit gerne verwendet, um die Gefäße, vor allem aber Kochtöpfe, feuerfester zu machen. Es fand während dieser Zeit ein großflächiger Handel, der die gesamte Verbreitung der Latène-Kultur umfasste, statt. Hier waren besonders die Vorkommen bei Passau und Krummau bedeutsam. Nach dem Zusammenbruch der keltischen Kultur in Mitteleuropa im Zuge der römischen Eroberung und der germanischen Expansion dauert es etwa 800 Jahre bis ins frühe Mittelalter, bis im slawischen Ostmitteleuropa im größeren Stil wieder Graphit verwendet wurde. In Asien (vor allem dem schon frühzeitig schriftkundigen China) hat Graphit als Schreibmaterial erstaunlicherweise keine Rolle gespielt.
Im 16. Jahrhundert entdeckten die Engländer ein großes Vorkommen an reinem Graphit, welches sie jedoch für eine Form des Bleiminerals Bleiglanz (Plumbago) hielten. Erst Carl Wilhelm Scheele gelang 1779 der Nachweis, dass es sich bei Graphit um reinen Kohlenstoff handelt. Trotz Scheeles Nachweis hält sich der Begriff Bleistift bis heute. Da sich Graphit nicht nur als gutes Schreibmaterial, sondern auch als perfektes Material für Gussformen von Kanonenkugeln herausstellte, hatte es auch eine gewisse militärische Bedeutung. So wurde deshalb z. B. während der napoleonischen Kriege Anfang des 19. Jahrhunderts die Ausfuhr von Bleistiften von Großbritannien nach Frankreich verboten.[4]
Klassifikation
In der mittlerweile veralteten Systematik der Minerale nach Strunz (8. Auflage) gehört der Graphit zur allgemeinen Abteilung der „Halbmetalle und Nichtmetalle“. Mit der Überarbeitung der Strunz'schen Mineralsystematik in der Systematik der Minerale nach Strunz (9. Auflage)#C Halbmetalle (Metalloide) und Nichtmetalle wurden die Abteilungen teilweise neu definiert und präziser in Element-Familien mit ähnlichen chemischen Eigenschaften unterteilt. Das Mineral findet sich entsprechend in der Abteilung der „Halbmetalle (Metalloide) und Nichtmetalle“ und dort zusammen mit Chaoit und Fullerit in der „Kohlenstoff-Silicium-Familie“.
Die im englischen Sprachraum bevorzugte Systematik der Minerale nach Dana ordnet den Graphit ebenfalls in die Element-Abteilung der „Halbmetalle und Nichtmetalle“ und dort zusammen mit Diamant, Lonsdaleit, Chaoit und Fullerit in die Unterabteilung der „Kohlenstoffpolymorphen“.
Modifikationen und Varietäten
Graphit ist neben Diamant und Fulleren die dritte unter irdischen Normalbedingungen stabile Form (Modifikation) des Kohlenstoffs. Eine weitere Modifikation, der Lonsdaleit, entsteht nur durch außergewöhnliche Schockereignisse wie beispielsweise bei einem Meteoriteneinschlag.
Bildung und Fundorte
Graphit kommt in der Natur in Form vereinzelter Flocken und Körner in kohlenstoffreichem metamorphem Gestein und als Adern in Pegmatit vor.
Graphitfundorte gibt es weltweit von Afghanistan (Kabul) bis Simbabwe (Harare, Mashonaland) [5]. Von wirtschaftlicher Bedeutung sind aber vor allem die Volksrepublik China, Korea, Madagaskar, Simbabwe, Brasilien und Indien sowohl im Tagebau als auch unter Tage. Pro Jahr handelt es sich dabei um ca. 600.000 Tonnen.
In Europa gibt es zurzeit nur noch wenige aktive Graphitbergwerke. In der Ukraine, in Norwegen und in Tschechien wird makrokristalliner Naturgraphit in unterschiedlicher Qualität unter Tage abgebaut. Bei dem makrokristallinen Naturgraphit sind die einzelnen Graphitkristallitpakete (Flocken) gut erhalten und sichtbar. In Österreich wurden dagegen mikrokristalline Naturgraphite gewonnen, deren Kristalle nicht so deutlich ausgeprägt sind.
Österreich nahm in den 1960er-Jahren den nach Südkorea zweiten Platz unter den graphiterzeugenden Ländern der Erde ein (Höchststand 1964 mit etwa 100.000 Tonnen Förderung). Der größte Bergbau befand sich in Kaisersberg bei Sankt Stefan ob Leoben in der Steiermark; dieser wurde 1997 stillgelegt; seit Frühjahr 2008 wird im dortigen "Marie-Stollen" wieder gearbeitet. Bis 1991 bestand in Sunk bei Trieben im Paltental (Steiermark) ein Bergbau, in dem Graphit mit einem sehr hohen Kohlenstoffanteil von zum Teil über 85 % gewonnen wurde. Weitere kleine Graphitbergbaue bestanden bis in die 1970er-Jahre am Semmering, im Liesingtal (Steiermark), im Dunkelsteiner Wald (Niederösterreich) sowie im Waldviertel, wobei hier das seit 1831 in Abbau stehende Vorkommen in Mühldorf[6] am bedeutendsten war. In Deutschland war der Graphit-Bergbau von Kropfmühl/Landkreis Passau bedeutsam, dieser spielt heute jedoch keine große Rolle mehr.
Synthetische Herstellung
Durch Verkoken kohlenstoffhaltiger Materialien entstehen graphitierbare Kohlenstoffe. Ausgangssubstanzen sind zum Beispiel Braunkohle, Steinkohle, Erdöl und Peche, aber auch Kunststoffe. Bei der Graphitierung erfolgt durch Erhitzen unter Luftabschluss auf etwa 3.000 °C noch eine Umwandlung vom amorphen Kohlenstoff zum polykristallinen Graphit.
Künstlich hergestellter Graphit ist auch als Acheson-Graphit bekannt. Die weltweit bedeutendsten Hersteller sind SGL Carbon (Deutschland), GRAFTECH (USA), TOYO TANSO (Japan), Schunk Kohlenstofftechnik (Deutschland), Graphite India (Indien), Morgan Crucible (Großbritannien) und Carbone Lorraine (Frankreich).
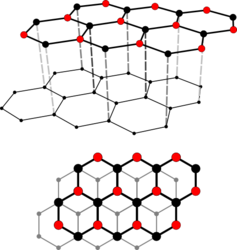
Kristallstruktur
Im kristallinen Graphit liegen parallel verlaufende ebene Schichten, die „Basalebenen“ oder „Graphen-Schichten“, vor. Eine Schicht besteht aus kovalent verknüpften Sechsecken, deren Kohlenstoff-Atome sp2-hybridisiert sind. Innerhalb dieser Ebenen beträgt die Bindungsenergie zwischen den Kohlenstoff-Atomen 4,3 Elektronenvolt, zwischen ihnen dagegen lediglich 0,07 Elektronenvolt. Aus dieser extremen Richtungsabhängigkeit der Bindungskräfte resultiert eine deutliche Anisotropie der mechanischen, elektrischen und thermischen Eigenschaften des Graphits:
- leichte Spaltbarkeit des reinen Graphits entlang der Basalebenen, deutlich höhere Festigkeit entlang der Kristallschichten;
- thermische und elektrische Isolation orthogonal zu den Basalebenen gegenüber einer fast metallischen Leitfähigkeit entlang der Ebenen.
Die Leitfähigkeit innerhalb einer Ebene wird durch die Delokalisation der π-Elektronen ermöglicht.
Die bekannten Schmiermitteleigenschaften von Graphit sind jedoch nicht nur strukturbedingt, denn sie treten nur in Gegenwart von Feuchtigkeitsspuren auf.[7]
Weisen die Ebenen keine feste Korrelation zueinander auf, spricht man von turbostratischem Kohlenstoff.
Die durchstrahlungs-elektronenmikroskopische (TEM-)Aufnahme zeigt Basalebenenstapel in Graphit. Die Überlagerung verkippter Stapel erzeugt Moiré-Streifen; die Basalebenenabstände von 0,335 Nanometer werden hier nicht aufgelöst. [1]
Im sogenannten Glaskohlenstoff liegen die Ebenen dagegen nicht planparallel wie die Seiten eines Buches, sondern wie geknülltes Papier. Dieser Kohlenstoff ist hart und isotrop wie Glas, daher sein Name. Durch besondere Behandlung (Streckung von Kunststofffasern und anschließendes Graphitieren) gelingt es, die Ebenen in Faserrichtung zu orientieren. Das Ergebnis sind hochfeste Kohlenstofffasern.
Fullerene und Nanoröhren besitzen nur eine Basalebene, die im ersten Fall zu einer Kugel, im zweiten Fall zu Röhren gekrümmt sind. Auch hier sind die Übergänge zum Graphit fließend. Weitere Schichten können sich zwiebelartig anlagern und rußartiges Pulver bilden.
-
Rastertunnelmikroskopische Aufnahme einer Graphitoberfläche. Zu sehen sind diejenigen Oberflächenatome (rot markiert im nebenstehenden Bild), die kein unmittelbares Nachbaratom in der nächstunteren Schicht besitzen (mit gestrichelten Linien verbundene Atompositionen), da hier die elektronische Zustandsdichte höher ist. Ein unteres C-Atom ändert die elektronische Struktur des darüberliegenden Atoms.
Verwendung
Nukleargraphit
Vor allem bis ca. 1990 wurde Graphit in hochgereinigter Form in Kernreaktoren als Moderator und bei den deutschen Kugelhaufenreaktoren zusätzlich als Brennelementmatrix eingesetzt. Die guten Moderationseigenschaften sowie die hohe Temperaturstabilität von Graphit waren ausschlaggebende Kriterien zur Wahl dieses Materials. Die Graphitbrände des britischen Windscale-Reaktors 1957 in Sellafield sowie des RBMK-Reaktors in Tschernobyl 1986 haben Bedenken bezüglich der sicherheitstechnischen Eignung von Graphit in Nuklearsystemen aufkommen lassen. Als Probleme hinzu kommen die Reaktionsfähigkeit mit Wasserdampf (> 900 °C) unter Bildung brennbarer Gase, sowie die Neigung zu nuklearen Instabilitäten im System Graphit/Wasser.
Derzeit gibt es weltweit 250.000 t bestrahlten Nukleargraphits (Deutschland ca. 1000 t), für den es wegen seines hohen Gehalts an C-14 (radioaktives Isotop mit einer Halbwertszeit von 5700 Jahren) noch keine ökonomisch akzeptable Endlagerstrategie gibt.[8]
Weitere Verwendungsmöglichkeiten
Graphit wird vielfältig genutzt als
- Bleistiftmine
- teilweise: Golfschläger
- teilweise: Badmintonschläger
- Festschmierstoff
- Werkstoff für selbstschmierende Lager und Dichtungen
- Füller zur Verbesserung der elektrischen Leitfähigkeit und zum Herabsetzen des Reibbeiwertes von Kunststoffen
- Kohlebürste in elektrischen Motoren
- Elektrode in Kohlebogenlampen und Lichtbogenofen
- negative Elektrode von Lithium-Ionen-Zellen
- positive Elektrode von Zink-Kohle-Primärbatterien
- Schmelztiegel
- Gießform
- thermisch hochbelastbare Ofenauskleidung
- Moderator und Reflektor in Atomreaktoren
- Monochromator im Röntgendiffraktometer
- Standardsubstrat in der Rastertunnelmikroskopie unter Umgebungsbedingungen.
- Waffe in Form von Graphitfäden zum Kurzschließen der feindlichen Stromversorgung (Graphitbombe)
- korrosionsbeständiger Werkstoff in der chemischen Industrie
- Wanne und Elektroden bei der Aluminiumherstellung (Schmelzflusselektrolyse)
- Legierungselement in Gusseisen
- Elektrode in der Elektro-Stahlgewinnung, Schrottverwertung
- Halbleiter
- Elektrode beim Senkerodieren
- Phasenwechselmaterial
Siehe auch
Einzelnachweise
- ↑ a b c Harry Marsh, Francisco Rodríguez-Reinoso: Science of Carbon Materials. 2000. Zitiert in: Christian Anton Rottmair: Einfluss der thermischen Prozessführung auf die Eigenschaften von Graphitformteilen, hergestellt durch Pulverspritzguss von Mesophasen-Kohlenstoff. 2007, S. 10-11 (Dissertationsarbeit, Universität Erlangen-Nürnberg, 2007, PDF).
- ↑ a b Thieme Chemistry (Hrsg.): Eintrag zu Graphit im Römpp Online. Version 3.14. Georg Thieme Verlag, Stuttgart 2011, abgerufen am 10. April 2011.
- ↑ Sicherheitsdatenblatt von Graphit
- ↑ Spektrum der Wissenschaft August 2008, S.86-93, Wunderstoff aus dem Bleistift
- ↑ Localities for Graphite (engl.)
- ↑ http://www.familie-wimmer.com/orte/o01/o01gra/index.html
- ↑ http://www.slac.stanford.edu/cgi-wrap/getdoc/slac-pub-10429.pdf
- ↑ J. Fachinger, W. von Lensa, T. Podruhzina: Decontamination of nuclear graphite. In: Proceedings HTR2006: 3rd International Topical Meeting on High Temperature Reactor Technology, October 1–4, 2006, Johannesburg, South Africa. 2006, S. J00000063 (PDF).
Literatur
- Ernst H. Weinschenk: Der Graphit, seine wichtigsten Vorkommnisse und seine technische Verwerthung. Verl.-Anst. und Dr. A.-G., Hamburg 1898 (Digitalisat der ULB Düsseldorf)
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. (Übersetzt von Werner Horwath). Edition Dörfler im Nebel Verlag, Eggolsheim 2002, ISBN 3-89555-076-0.
- Stefan Weiß: Das große Lapis Mineralienverzeichnis. 4. Auflage. Weise, München 2002, ISBN 3-921656-17-6.
- Eugen Ryschkewitsch: Graphit. Charakteristik, Erzeugung, Verarbeitung und Verwendung. S. Hirzel, Leipzig 1926.
- Irene Kappel: Die Graphittonkeramik von Manching. F. Steiner, Wiesbaden 1969.
- Wolfgang Delle et al. Graphitische Werkstoffe für den Einsatz in Kernreaktoren. 2. polykristalliner Graphit und Brennelementmatrix Thiemig, München, 1983
Weblinks
Kategorien:- Digitalisierte Literatur der Universitäts- und Landesbibliothek Düsseldorf
- Trockenschmierstoff
- Mineral
- Hexagonales Kristallsystem
- Elemente (Mineralklasse)
- Kohlenstoffmineral
- Elementmodifikation
- Elektrotechnischer Werkstoff
Wikimedia Foundation.