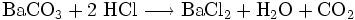- BaCl2
-
Kristallstruktur -chlorid.png)
__ Ba2+ __ Cl- Allgemeines Name Bariumchlorid Andere Namen Chlorbarium (veraltet)
Verhältnisformel BaCl2 CAS-Nummer 10361-37-2 Kurzbeschreibung weißes, kristallines Pulver Eigenschaften Molare Masse 208,27 g·mol−1 Aggregatzustand fest
Dichte 3,9 g·cm−3[1]
Schmelzpunkt 963 °C[1]
Siedepunkt 1560 °C[1]
Löslichkeit gut in Wasser (375 g·l−1[1])
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Giftig (T) R- und S-Sätze R: 20-25 S: (1/2)-45 MAK 0,5 mg/m3 (Ba)[1]
LD50 118 mg/kg (oral, Ratte) [1]
Thermodynamische Eigenschaften ΔHf0 −859,8 kJ·mol−1[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumchlorid, unter Normalbedingungen ein weißes, kristallines Pulver, ist eine anorganische chemische Verbindung. Häufig kommt Bariumchlorid in Verbindung mit zwei Wassermolekülen vor. Obwohl Bariumchlorid giftig ist, wird es vielfach eingesetzt.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bariumchlorid lässt sich nach allen Salzbildungsreaktionen darstellen:
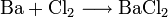
- Barium reagiert mit Chlor zu Bariumchlorid.
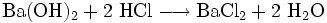
- Bariumhydroxid reagiert mit Salzsäure zu Bariumchlorid und Wasser.

- Bariumoxid reagiert mit Salzsäure zu Bariumchlorid und Wasser.
Kommerziell wird Bariumchlorid durch Reaktion von Bariumsulfid mit Salzsäure unter Bildung von Schwefelwasserstoffsäure synthetisiert:
Auch durch Reaktion von Bariumcarbonat mit Salzsäure entsteht Bariumchlorid bei gleichzeitiger Bildung von Wasser und Kohlenstoffdioxid:
Eigenschaften
Physikalische Eigensachaften
Bariumchlorid ist ein farbloses, kristallines Pulver mit einem Schmelzpunkt von 963 °C. Bariumchlorid weist wie Barium und alle seine Salze eine grüne Flammenfärbung auf, es ist gut in Wasser löslich und wie alle löslichen Bariumverbindungen giftig.
Bariumchlorid kommt meist in Verbindung mit zwei Molekülen Kristallwasser, als Bariumchlorid-dihyrat vor. Wasserfreies Bariumchlorid erhält man, wenn man Bariumchloriddihydrat das Wasser durch Wärme entzieht (Dehydratation). Auch Bariumchloriddihydrat ist ein weißes, kristallines Pulver.
Chemische Eigenschaften
Reaktion mit Sulfat-Ionen:

- Magnesiumsulfat reagiert mit Bariumchlorid zu Bariumsulfat und Magnesiumchlorid.
Reaktion mit Kaliumchromat:
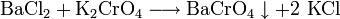
- Bariumchlorid reagiert mit Kaliumchromat zu Bariumchromat und Kaliumchlorid.
Verwendung
Bariumchlorid wird als Indikator für Sulfat-Ionen angewandt, da bei der Reaktion mit Sulfat-Ionen (siehe Reaktionen) Bariumsulfat als weißer Feststoff ausfällt. Diese Fällungsreaktion kann auch zur Reinigung von Natriumchlorid von Sulfaten eingesetzt werden.
Außerdem wird Bariumchlorid zum Härten von Stahl, in der Pyrotechnik aufgrund seiner grünen Flammenfärbung und zur Herstellung der Farbstoffe Bariumsulfat (siehe Reaktionen) und Bariumchromat (siehe Reaktionen) benutzt.
Die Rote Armee benutzte während des Zweiten Weltkriegs grünlich leuchtende Bariumchlorid-Leuchtspurgeschosse, um dem Schützen das Zielen zu erleichtern, während die Deutsche Wehrmacht gelblich leuchtende Phosphor-Geschosse verwendete. Diese Geschosse wurden in den LMGs und MGs der Panzer eingesetzt. Auch halfen diese Geschosse anderen Soldaten, da sie sahen, wohin der Schütze zielte.
Toxizität
Bariumchlorid ist schwach wassergefährdend. Bariumchlorid ist giftig beim Einatmen und Verschlucken. Bei Unfall oder Unwohlsein auf Grund dieses Stoffes ist sofort ein Arzt hinzuzuziehen. Als Erste-Hilfe-Maßnahme ist die Einnahme von Natrium- bzw. Kaliumsulfatlösung zu empfehlen, da Sulfationen die Bariumionen ausfällen und dabei unlösliches und somit ungiftiges Bariumsulfat bilden. Bariumchlorid ist unter Verschluss und für Kinder unzugänglich aufzubewahren.
Einzelnachweise
- ↑ a b c d e f Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu CAS-Nr. 10361-37-2 im European chemical Substances Information System ESIS
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
Wikimedia Foundation.