- Bariumoxid
-
Kristallstruktur 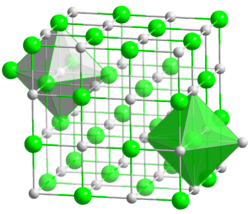
__ Ba2+ __ O2− Kristallsystem kubisch
Raumgruppe 
Koordinationszahlen Ba[6], O[6]
Allgemeines Name Bariumoxid Verhältnisformel BaO CAS-Nummer 1304-28-5 Kurzbeschreibung farbloses Pulver[1]
Eigenschaften Molare Masse 153,32 g·mol−1 Aggregatzustand fest
Dichte 5,72 g·cm−3[2]
Schmelzpunkt Siedepunkt 2000 °C[2]
Löslichkeit In Wasser Zersetzung zu Bariumhydroxid[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 301-314-332 EUH: keine EUH-Sätze P: 280-301+310-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/22 S: (2)-28 MAK 0,5 mg·m−3 (Ba)[2]
Thermodynamische Eigenschaften ΔHf0 −554 kJ·mol−1[5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumoxid ist das Oxid des Erdalkalimetalls Barium. Es besitzt die Formel BaO.
Inhaltsverzeichnis
Eigenschaften
Bariumoxid ist ein farbloser Feststoff, der bei 1918 °C schmilzt. Mit Wasser reagiert es unter lebhafter Wärmeentwicklung zu Bariumhydroxid.
Darstellung
Technisch wird es durch das Erhitzen eines Kohle-Bariumcarbonat-Gemisches auf etwa 1030 °C hergestellt, im Laboratorium auch durch Glühen von Bariumnitrat.[1]
Verwendung
Bariumoxid wird als Absorptionsmittel für Kohlenstoffdioxid und Wasser sowie zur Herstellung von Bariumperoxid, Bariumhydroxid, organischen Bariumsalzen, Spezialgläsern und Oxidkathoden verwendet.
Bariumoxid unterliegt an Sauerstoffatmosphäre einer Gleichgewichtsreaktion zu Bariumperoxid BaO2.
Zwischen 500 und 600 °C reagiert BaO zum Bariumperoxid. Oberhalb von 600 °C wird der im Peroxid gebundene Sauerstoff wieder abgegeben. BaO darf also nicht zu sehr erhitzt werden, da die Gleichgewichtsreaktion zum Bariumperoxid mit Wärmeabgabe (exotherme Reaktion) und Volumenänderung verbunden ist, verschiebt sich das Gleichgewicht mit steigender Temperatur nach links. Man kann daher Sauerstoff bei niedriger Temperatur binden und bei höherer Temperatur wieder freisetzen.
Einzelnachweise
- ↑ a b Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e Datenblatt Bariumoxid bei AlfaAesar, abgerufen am 29. Januar 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Bariumoxid bei Sigma-Aldrich, abgerufen am 9. März 2011.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bariumsalze“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
ErdalkalimetalloxideBerylliumoxid | Magnesiumoxid | Calciumoxid | Strontiumoxid | Bariumoxid | Radiumoxid
Wikimedia Foundation.



