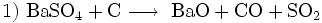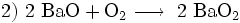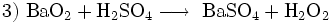- BaO2
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Bariumperoxid Andere Namen Bariumsuperoxid
Summenformel BaO2 CAS-Nummer 1304-29-6 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 169,34 g·mol−1 Aggregatzustand fest
Dichte 4,96 g·cm−3[1]
Schmelzpunkt 450 °C[1]
Siedepunkt Zersetzung bei 800 °C[1]
Löslichkeit gering in Wasser (Zersetzung)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Brand-
förderndGesundheits-
schädlich(O) (Xn) R- und S-Sätze R: 8-20/22 S: (2)-13-27 MAK 0,5 g/m3 (Barium)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumperoxid ist eine chemische Verbindung der Elemente Barium und Sauerstoff mit der Summenformel BaO2. Beim Erhitzen über 700 °C gibt BaO2 Sauerstoff ab. Bariumperoxid kann aufgrund seiner Verwandtschaft zum H2O2 als Oxidations- wie auch als Reduktionsmittel wirken.
Inhaltsverzeichnis
Geschichte
Erste bekannt gewordene Peroxo-Verbindung durch Alexander von Humboldt (1799).[4]
Herstellung
Hergestellt wird Bariumperoxid, indem Bariumoxid unter erhöhtem Druck mit Luft auf etwa 500 °C erhitzt wird.
Im Labor kann es auch aus Bariumchloridlösung und Wasserstoffperoxid im Basischen gewonnen werden. Dabei entsteht zunächst das Oktahydrat, das anschließend durch Erhitzen in Bariumperoxid umgewandelt werden kann.Verwendung
Bariumperoxid wird hauptsächlich in der Pyrotechnik als Sauerstofflieferant und zur Erzeugung von grünen Flammenfärbungen verwendet. Mit Magnesiumpulver findet es in Zündkirschen Anwendung. Auch dient es zum Entfärben von Bleigläsern und zum Bleichen von Stroh und Seide.
Früher spielte Bariumperoxid zur großtechnischen Herstellung von Wasserstoffperoxid eine große Rolle:
Erläuterung:
- Umwandlung des Sulfats in das Oxid, das SO2 wird zur Herstellung der im dritten Schritt benötigten Schwefelsäure eingesetzt.
- Synthese des Bariumperoxids
- Gewinnung des Wasserstoffperoxids; das BaSO4 wird als Rohstoff in den Kreislauf zurückgegeben
Heutzutage ist dieses Vorgehen praktisch vollständig vom energetisch weniger aufwändigen Anthrachinon-Verfahren verdrängt.
Quellen
- ↑ a b c d Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu CAS-Nr. 1304-29-6 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt(alfa-aesar)
- ↑ Winnacker Küchler, Chemische Technololgie Band 1, 3. Auflage 1970, Seite 514
Literatur
- Römpp Chemie-Lexikon, 9. Auflage. Thieme-Verlag.
Wikimedia Foundation.