- Bariumchlorid
-
Kristallstruktur 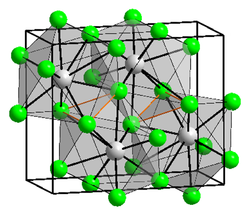
__ Ba2+ __ Cl− Allgemeines Name Bariumchlorid Andere Namen Chlorbarium (veraltet)
Verhältnisformel BaCl2 CAS-Nummer - 10361-37-2
- 22322-71-0 (Hydrat)
- 10326-27-9 (Dihydrat)
Kurzbeschreibung farblose, kubische oder monokline Kristalle[1]
Eigenschaften Molare Masse 208,23 g·mol−1 Aggregatzustand fest
Dichte 3,86 g·cm−3[1]
Schmelzpunkt Siedepunkt 1560 °C[2]
Löslichkeit gut in Wasser (375 g·l−1[2])
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Gefahr
H- und P-Sätze H: 301-332 EUH: keine EUH-Sätze P: 301+310 [4] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 20-25 S: (1/2)-45 MAK 0,5 mg·m−3 (Ba)[2]
LD50 118 mg·kg−1 (oral, Ratte) [2]
Thermodynamische Eigenschaften ΔHf0 −859,8 kJ·mol−1[5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumchlorid ist eine farblose, kristalline chemische Verbindung und ein Chlorid des Bariums. Häufig liegt Bariumchlorid als Dihydrat (BaCl2 · 2 H2O) vor.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bariumchlorid lässt sich nach allen Salzbildungsreaktionen darstellen:

- Barium reagiert mit Chlor zu Bariumchlorid.

- Bariumhydroxid reagiert mit Salzsäure zu Bariumchlorid und Wasser.

- Bariumoxid reagiert mit Salzsäure zu Bariumchlorid und Wasser.
Kommerziell wird Bariumchlorid durch Reaktion von Bariumsulfid mit Salzsäure unter Bildung von Schwefelwasserstoffsäure synthetisiert:[1]
Auch durch Reaktion von Bariumcarbonat mit Salzsäure entsteht Bariumchlorid bei gleichzeitiger Bildung von Wasser und Kohlenstoffdioxid:[1]
Eigenschaften
Physikalische Eigenschaften
Bariumchlorid ist ein farbloses, kristallines Pulver mit einem Schmelzpunkt von 963 °C. Bariumchlorid weist wie Barium und alle seine Salze eine grüne Flammenfärbung auf, es ist gut in Wasser löslich und wie alle löslichen Bariumverbindungen giftig.
Bariumchlorid kommt meist in Verbindung mit zwei Molekülen Kristallwasser als Bariumchlorid-dihydrat vor. Wasserfreies Bariumchlorid erhält man, wenn man Bariumchloriddihydrat das Wasser durch Wärme entzieht (Dehydratation). Auch Bariumchloriddihydrat ist ein weißes, kristallines Pulver.
Chemische Eigenschaften
Reaktion mit Sulfat-Ionen:

- Magnesiumsulfat reagiert mit Bariumchlorid zu Bariumsulfat und Magnesiumchlorid.
Reaktion mit Kaliumchromat:

- Bariumchlorid reagiert mit Kaliumchromat zu Bariumchromat und Kaliumchlorid.
Verwendung
Bariumchlorid wird als Indikator für Sulfat-Ionen angewandt, da bei der Reaktion mit Sulfat-Ionen (siehe Reaktionen) Bariumsulfat als weißer Feststoff ausfällt. Diese Fällungsreaktion kann auch zur Reinigung von Natriumchlorid von Sulfaten eingesetzt werden.
Außerdem wird Bariumchlorid zum Härten von Stahl, in der Pyrotechnik aufgrund seiner grünen Flammenfärbung und zur Herstellung der Farbstoffe Bariumsulfat (siehe Reaktionen) und Bariumchromat (siehe Reaktionen) benutzt.
Die Rote Armee benutzte während des Zweiten Weltkriegs grünlich leuchtende Bariumchlorid-Leuchtspurgeschosse, um dem Schützen das Zielen zu erleichtern, während die Wehrmacht gelblich leuchtende Phosphor-Geschosse verwendete. Diese Geschosse wurden in den LMGs und MGs der Panzer eingesetzt. Auch halfen diese Geschosse anderen Soldaten, da sie sahen, wohin der Schütze zielte.
Toxizität
Bariumchlorid ist schwach wassergefährdend. Bariumchlorid ist giftig beim Einatmen und Verschlucken. Bei Unfall oder Unwohlsein auf Grund dieses Stoffes ist sofort ein Arzt hinzuzuziehen. Bariumchlorid ist unter Verschluss und für Kinder unzugänglich aufzubewahren.
Barium inaktiviert die passiven Kaliumkanäle in der Membran der Muskelzellen. Kalium kann so die Muskelzellen nicht mehr verlassen. Da die Natrium-Kalium-ATPase unvermindert Kalium in die Zellen pumpt, kommt es zum Abfall der Kalium-Spiegel im Blut. Die Symptome sind Hypermotilität des Magen-Darm-Traktes, Ausfall der Muskelreflexe (Areflexie), schlaffe Muskellähmung und Atemlähmung. Bei der Blutuntersuchung findet sich eine schwere Hypokaliämie.[6]
Als Erste-Hilfe-Maßnahme ist die Einnahme von Natrium- bzw. Kaliumsulfatlösung zu empfehlen, da Sulfationen die Bariumionen ausfällen und dabei unlösliches und somit ungiftiges Bariumsulfat bilden. Im Krankenhaus kann Barium durch Dialyse entfernt werden.
Einzelnachweise
- ↑ a b c d Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e Datenblatt Bariumchlorid bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Eintrag zu CAS-Nr. 10361-37-2 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Eintrag zu CAS-Nr. 10361-37-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. März 2011 (JavaScript erforderlich)
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ Yu-Jen Su, et al.: An Industrial Worker Hospitalized With Paralysis After an Aerosolized Chemical Exposure. In: American Journal of Kidney Diseases. 56, Nr. 3, 2010, S. A38-A41. doi:10.1053/j.ajkd.2010.02.004. Abgerufen am 22. September 2010.
Schlagen Sie auch in anderen Wörterbüchern nach:
Bariumchlorid — Ba|ri|um|chlo|rid: BaCl2; farblose Kristalle, Smp. 962 °C, die zur Herst. von Blanc fixe (↑ Bariumsulfat) dienen … Universal-Lexikon
BaCl2 — Kristallstruktur Ba2+ Cl … Deutsch Wikipedia
Chlorbarium — Kristallstruktur Ba2+ Cl … Deutsch Wikipedia
Die Entdeckung der Kernspaltung — Kaiser Wilhelm Institut für Chemie (heute: Otto Hahn Bau der Freien Universität Berlin) 52.44866613.3429597Koordinaten … Deutsch Wikipedia
Entdeckung der Kernspaltung — Kernspaltung des Uranatoms: Sonderbriefmarke der Deutschen Bundespost von 1979 … Deutsch Wikipedia
Geschichte der Kernspaltung — Kaiser Wilhelm Institut für Chemie (heute: Otto Hahn Bau der Freien Universität Berlin) 52.44866613.3429597Koordinaten … Deutsch Wikipedia
Entdeckung des Radiums — Dieser Artikel wurde den Mitarbeitern der Redaktion Physik zur Qualitätssicherung aufgetragen. Wenn Du Dich mit dem Thema auskennst, bist Du herzlich eingeladen, Dich an der Prüfung und möglichen Verbesserung des Artikels zu beteiligen. Der… … Deutsch Wikipedia
Barium — Eigenschaften … Deutsch Wikipedia
Kupferrauch — Strukturformel Zn2+ + Allgemeines Name Zinksulfat Andere Namen Zink(II) sulfat Zinkvitriol … Deutsch Wikipedia
Schwefelsaures Zinkoxyd — Strukturformel Zn2+ + Allgemeines Name Zinksulfat Andere Namen Zink(II) sulfat Zinkvitriol … Deutsch Wikipedia



