- Stavudin
-
Strukturformel 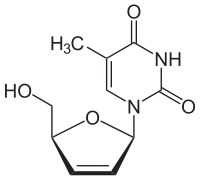
Allgemeines Freiname Stavudin Andere Namen - 1-[(2R,5S)-5-(Hydroxymethyl)- 2,5-dihydrofuran-2-yl]- 5-methylpyrimidin-2,4-dion
- dde Thd
- DTH
- D4T
Summenformel C10H12N2O4 CAS-Nummer 3056-17-5 PubChem 18283 ATC-Code J05AF04
DrugBank DB00649 Arzneistoffangaben Wirkstoffklasse Virostatikum, nukleosidische Reverse-Transkriptase-Inhibitoren
Wirkmechanismus Verschreibungspflichtig: Ja Eigenschaften Molare Masse 224,21 g·mol−1 Schmelzpunkt Löslichkeit löslich in Wasser (6,6 g·l−1 bei 25 °C)[2]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stavudin (d4T) (Handelsname: Zerit®; Hersteller: Bristol-Myers Squibb) ist ein Arzneistoff zur Behandlung von mit HIV-1 infizierten Patienten im Rahmen einer antiretroviralen Kombinationstherapie.
Er gehört zur Gruppe der nukleosidischen Reverse-Trankriptase-Inhibitoren (NRTI).
Inhaltsverzeichnis
Eigenschaften
Stavudin kann in vier verschiedenen Kristallformen auftreten. Die polymorphen Formen I, II und IV unterscheiden sich anhand ihrer Schmelzpunkte mit 168,1 °C, 165,5 °C und 169,5 °C. Form I ist die bei Raumtemperatur thermodynamisch stabile Form. Bei Form III handelt es sich um 1/3-Hydrat mit einem stöchiometrischen Verhältnis von Wirkstoff zu Wasser von 3 : 1 im Kristallgitter.[1]
Pharmakologie
In-vitro wurde die antiretrovirale Aktivität von Stavudin nachgewiesen. Die Substanz ist in-vitro ca. 5–10 mal schwächer als Zidovudin. In Kombination mit anderen antiviralen Wirkstoffen konnten synergistische Wirkungen nachgewiesen werden. Die Entwicklung Stavudin-resistenter HI-Viren wurde in-vitro nachgewiesen.
Pharmakokinetik
Die Bioverfügbarkeit von Stavudin ist gut. Etwa 90 % werden oral resorbiert. Die gleichzeitige Einnahme mit der Nahrung, hat nur geringe, klinisch nicht relevante, Auswirkungen. Nach Einnahme von 40 mg werden im Plasma Spitzenkonzentrationen von ca. 0,8–1,0 mg/l erzielt. Liquorkonzentrationen: bis ca. 70 % der Plasmakonzentrationen. Eliminationshalbwertzeit: ca. 1,6 Stunden. Intrazelluläre Halbwertzeit des biologisch aktiven Triphosphates: ca. 3,5 Stunden.
Nebenwirkungen
Stark mitochondrial toxisch. Lipoatrophie. Periphere Neuropathien (PNP), vor Allem in Kombination mit DDI. Selten Diarrhoe, Übelkeit, Kopfschmerzen. Steatosis hepatis, Pankreatitis. Sehr selten: Laktatazidose. Keine Kombination mit AZT, wegen Antagonismus. Kontraindiziert bei PNP. Neurotoxische Medikamente vermeiden (Ethambutol, Cisplatin, INH, Vincristin etc.).
Einzelnachweise
- ↑ a b c d Lu, J.; Rohani, S.: Polymorphic Crystallization and Transformation of the Anti-Viral/HIV Drug Stavudine in Org. Proc. Res. Dev. 13 (2009) 1262–1268, doi:10.1021/op900004c.
- ↑ a b Stavudin bei ChemIDplus.
- ↑ Datenblatt Stavudin bei Sigma-Aldrich, abgerufen am 26. Februar 2009.
Weblinks
- AIDSMeds.com
- Informationen für Ärzte und Apotheker zur rationalen Infektionstherapie: Stavudin, ein weiteres Nukleosid-Analogon zur Behandlung der HIV-Infektion

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-J05
- Arzneistoff
- Nukleosid
- Pyrimidin
- Harnstoff
- Reverse-Transkriptase-Inhibitor
Wikimedia Foundation.
