- Steglich-Veresterung
-
Die Steglich-Veresterung ist eine Variante der Veresterung, bei der als Kopplungsreagenz Dicyclohexylcarbodiimid (DCC) und als Katalysator 4-(Dimethylamino)-pyridin (DMAP) dienen. Erstmals beschrieben wurde sie 1978 von Wolfgang Steglich. [1] Sie stellt eine Anpassung der schon länger zur Bildung von Amidbindungen bekannten Methode mittels DCC und 1-Hydroxybenzotriazol (HOBT) dar.[2][3]
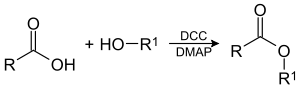
Allgemeine Reaktionsgleichung:
Die Reaktion wird gewöhnlich bei Raumtemperatur durchgeführt. Als Lösungsmittel eignet sich z. B. Dichlormethan. Da die Reaktion unter milden Bedingungen stattfindet, können so auch Ester dargestellt werden, die auf anderem Wege nicht oder nur in geringen Ausbeuten zugänglich sind, beispielsweise Ester der empfindlichen 1,4-Dihydrobenzoesäure.
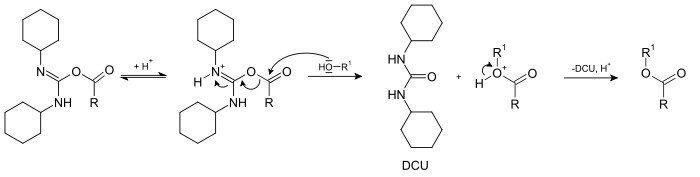
Charakteristisch für diese Reaktion ist die (formale) Aufnahme des bei der Reaktion entstehenden Wassers durch das DCC, welches sich dabei in das entsprechende Harnstoffderivat Dicyclohexylharnstoff (DCU, "U" steht für die lat. Bezeichnung "Urea" für Harnstoff) umwandelt.
Inhaltsverzeichnis
Reaktionsmechanismus
Der Ablauf dieser Reaktion lässt sich wie folgt darstellen:
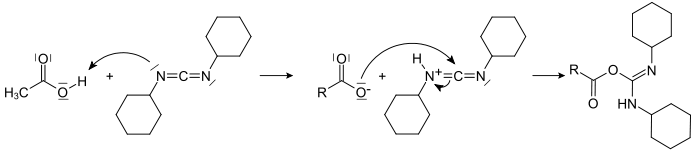
- Zunächst reagiert die Carbonsäure mit dem DCC zu einem O-Acylisoharnstoff, dessen Reaktivität im Vergleich zur freien Säure erhöht ist.
- Der Alkohol kann jetzt am O-Acylisoharnstoff angreifen, wobei sich DCU und der entsprechende Ester bilden.
Bei der analogen Reaktion mit Aminen verläuft die Bildung des entsprechenden Amids problemlos, da Amine als starke Nucleophile schnell reagieren. Eine Veresterung verläuft dem gegenüber langsamer, so dass eine Nebenreaktion verstärkt auftritt, die die Gesamtausbeute an Ester verringert und/oder die anschließende Trennung der Produkte erschwert. Diese Nebenreaktion ist eine 1,3-Umlagerung des O-Acylisoharnstoffs zu einem N-Acylharnstoff, der aufgrund seiner Stabilität nicht mehr mit einem Alkohol weiterreagieren kann.
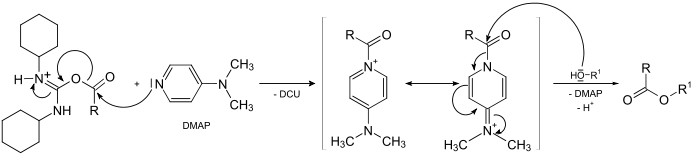
Zur Unterdrückung dieser Nebenreaktion wird DMAP zugegeben, das als Acylgruppen-Übertrager in folgender Weise fungiert und damit eine Umlagerung verhindert.
Quellen
- ↑ B. Neises, W. Steglich: Simple Method for the Esterification of Carboxylic Acids. In: Angew. Chem. Int. Ed. 1978, 17, 522–524.
- ↑ J. C. Sheehan, G. P. Hess: A New Method of Forming Peptide Bonds. In: J. Am. Chem. Soc. 1955, 77, 1067-1068.
- ↑ W. König, R. Geiger: Eine neue Methode zur Synthese von Peptiden: Aktivierung der Carboxygruppe mit Dicyclohexylcarbodiimid unter Zusatz von 1-Hydroxy-benzotriazolen. In: Chem. Ber. 1970, 103, 788–798.
Literatur
- J. Otera: Esterification. 1. Auflage, Wiley-VCH, Weinheim, 2003, ISBN 3-527-30490-8
Weblinks
Wikimedia Foundation.