- 1-Hydroxybenzotriazol
-
Strukturformel 
Allgemeines Name 1-Hydroxybenzotriazol Andere Namen - N-Hydroxybenzotriazol
- HOBt
Summenformel C6H5N3O CAS-Nummer - 2592-95-2
- 123333-53-9 (Hydrat)
PubChem 75771 Kurzbeschreibung farbloser Feststoff[1]
Eigenschaften Molare Masse 135,12 g·mol−1 Aggregatzustand fest
Schmelzpunkt pKs-Wert 4,6[5]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [6] 
Gefahr
H- und P-Sätze H: 203 EUH: keine EUH-Sätze P: 370+380-501 [7] EU-Gefahrstoffkennzeichnung [1] 
Explosions-
gefährlich(E) R- und S-Sätze R: 2 S: 16-35 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1-Hydroxybenzotrizol (abgekürzt auch oft als HOBt) ist ein in 1-Stellung mit einer Hydroxygruppe substituiertes Derivat des Benzotriazols. Resultierend aus der Struktur mit einem Triazolring und einer Stickstoff-Sauerstoff-Bindung ist die Verbindung thermisch instabil und gilt als explosionsgefährlich. Die wichtigste Anwendung erfolgt als Reagenz in der Peptidsynthese. Die Verbindung enthält die Basisstruktur für weitere in der Peptidsynthese wichtige Benzotriazolderivate wie TBTU und HBTU.
Inhaltsverzeichnis
Darstellung und Gewinnung
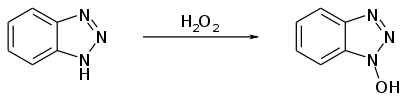
Eine Herstellung gelingt durch die Oxidation von Benzotriazol mit Wasserstoffperoxid in Gegenwart von Natriumwolframat.[8]
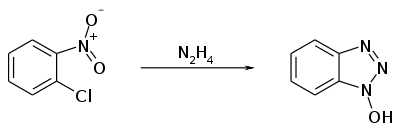
Eine weitere Synthesevariante ist die Zyklisierung von 2-Chlornitrobenzol mittels Hydrazinhydrat.[9]
Eigenschaften
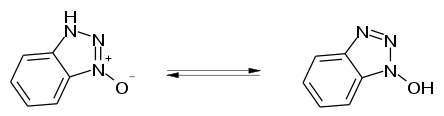
1-Hydroxybenzotriazol kann in zwei tautomeren Formen vorliegen.[3] Das Gleichgewicht liegt zwischen den N-Oxid- und N-Hydroxy-Tautomeren. Ein drittes, mögliches Tautomer als 1-Oxy-2H-benzotriazol ist thermodynamisch instabil und spielt praktisch keine Rolle.[10][11] Die Gleichgewichtslage hängt von der Art der Lösungsmittel ab. In wässrigem Medium ist das N-Oxid-Tautomer bevorzugt, in organischen Lösungsmitteln wie Methanol, Ethanol, Aceton, Formamid und Dimethylsulfoxid dominiert das N-Hydroxy-Tautomer.[3][10][11] Das N-Oxid-Tautomer kristallisiert aus wäßrigem Methanol und fällt als Monohydrat mit 11,7 % Wasser an.[2] Die farblosen Kristalle zeigen einen Schmelzpunkt bei 159–161 °C und bilden ein monoklines Kristallgitter mit der Raumgruppe P21/C.)[2] Das N-Hydroxy-Tautomer kann aus wasserfreien Ethanol/Ether-Gemischen gewonnen werden.[3] Es bildet ebenfalls farblose Kristalle, die bei 169–170 °C schmelzen. Das Kristallgitter ist monoklin mit der Raumgruppe C2/c.[2]
Oberhalb des Schmelzpunktes wird eine stark exotherme Zersetzung mit einer Zersetzungswärme von -2259 kJ·kg-1 beobachtet.[12] In Deutschland ist 1-Hydroxybenzotriazol entsprechend der Regelungen des Sprengstoffgesetzes als explosionsgefährlicher Stoff eingestuft.[13] Der wasserfreie Stoff ist dabei der Stoffgruppe B zugeordnet. Mischungen mit einem Wassergehalt zwischen 20 % und 47 % fallen noch in die Stoffgruppe C.[13] Im Stahlhülsentest liegt der Grenzdurchmesser der Lochplatte für wasserfreies Material bei 10 mm.[12] Der Grenzdurchmesser sinkt mit zunehmenden Wassergehalt. Mit einem Wassergehalt von 50 % wird allerdings noch ein im Sinne des Sprengstoffgesetzes relevanter Grenzdurchmesser von 2 mm beobachtet.[14] Die Verbindung ist schlagempfindlich. Für wasserfreies 1-Hydroxybenzotriazol reicht eine Schlagenergie von 10 J. Mit einem Wassergehalt bis 20 % ist eine Schlagenergie von 20 J notwendig.[14] Kommerziell ist HOBt ausschließlich als Hydrat im Handel, da dieses als Gefahrgut der Klasser 4.1 als brennbarer Feststoff eingestuft ist. Reines HOBt fällt unter die Gefahrgutklasse 1.3C Explosivstoffe.[14] Der hieraus resultierende erhöhte Aufwand für den Transport und auch die Lagerung ist meist unwirtschaftlich.
Verwendung
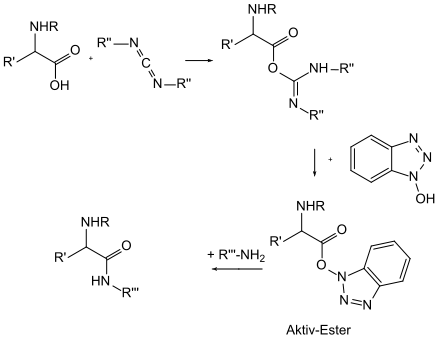
1-Hydroxybenzotriazol (abgekürzt HOBt) ist ein wichtiges Reagenz in der Peptidsynthese sowohl in Lösung als auch in fester Phase. HOBt wird benutzt, um einen sogenannten Aktivester aus einer durch ein Carbodiimid aktivierten Carbonsäure (meist einer geschützten Aminosäure) herzustellen. Diese Aktivester reagieren mit Aminen zu den entsprechenden Peptidbindungen (oder besser Amiden). Die Reaktion mit HOBt als Hilfsreagenz zeichnet sich durch eine racemisierungsarme Reaktion aus, findet bei Raumtemperatur statt und hat in der Regel bessere Ausbeuten im Vergleich zu direkten Kupplungen.
Literatur
- W. C. Chan, P. D. White: Fmoc Solid Phase Peptide Synthesis. Reprint 2004, Oxford University Press, ISBN 0-19-963724-5.
Einzelnachweise
- ↑ a b Eintrag zu CAS-Nr. 2592-95-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. April 2011 (JavaScript erforderlich).
- ↑ a b c d Bosch, R.; Jung, G.; Winter, W.: Benzotriazole 1-oxide and 1-hydroxybenzotriazole, C6H5N3O: structures of both tautomeric forms in Acta Crystallogr. Sect. C 39 (1983) 1089–1092, doi:10.1107/S0108270183007490.
- ↑ a b c d e Pfister-Guillouzo, G.; Gracian, F.; Paez, J.A.; Gomez, C.G.; Elguero, J.: Study of 1-hydroxybenzotriazole/benzotriazole N-oxide tautomerism in gas phase by photoelectron spectroscopy in Spectrochim. Acta A51 (1995) 1801–1807, doi:10.1016/0584-8539(95)01441-V.
- ↑ Boyle, F.T.; Jones, R.A.Y.: Azole N-oxides. Part I. The tautomerism of benzotriazole 1-oxide and its 4- and 6-nitro-derivatives with the corresponding 1-hydroxybenzotriazoles in J. Chem. Soc. Perkin Trans. 2, 1973, 160–164, doi:10.1039/P29730000160.
- ↑ Koppel, I.; Koppel, J.; Leito, I.; Pihl, V.; Grehn, L.; Ragnarsson, U.: in J. Chem. Res. 11 (1993) 3008-3028.
- ↑ Eintrag zu CAS-Nr. 2592-95-2 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt 1-Hydroxybenzotriazole hydrate bei Sigma-Aldrich, abgerufen am 15. April 2011.
- ↑ Kruglik, A. P.; Rakhman'ko, E. M.; Asratyan, G. V.: in J. Appl. Chem. USSR (Engl. Transl.) 62 (1989) 2385–2386, 2216–2218.
- ↑ Fu, Jie; Yang, Ying; Zhang, Xue-Wei; Mao, Wen-Jun; Zhang, Zhi-Ming; Zhu, Hai-Liang: Discovery of 1H-benzo[d][1,2,3]triazol-1-yl 3,4,5-trimethoxybenzoate as a potential antiproliferative agent by inhibiting histone deacetylase in Bioorg. Med. Chem. 18 (2010) 8457–8462, doi:10.1016/j.bmc.2010.10.049.
- ↑ a b Fruchier, A.; Elguero; J.; Hagarty, A.F.; McGarthy, D.G.: NMR studies in the heterocyclic series. XX—a carbon-13 NMR study of the structures of N-hydroxybenzotriazole and its acylated derivatives in Org. Magn. Reson. 13 (1980) 339–342, doi:10.1002/mrc.1270130508.
- ↑ a b Schilf, W.; Stefaniak, L.; Witanowski, M.; Webb, G.A.: 15N NMR studies of the tautomeric equilibrium of some 1-hydroxybenzotriazoles in Magn. Reson. Chem. 23 (1985) 181–184, doi:10.1002/mrc.1260230310.
- ↑ a b Wehrstedt, K.D.; Wandrey, P.A.; Heitkamp, D.: Explosive properties of 1-hydroxybenzotriazoles in J. Hazard. Mat. A126 (2005) 1–7, doi:10.1016/j.jhazmat.2005.05.044.
- ↑ a b BAM-Bescheide Nr. 416 vom 21. Mai 2002, Nr. 435 vom 23. Januar 2003 und Nr. 471 vom 6. Juni 2010.
- ↑ a b c UNECE ECOSOC Sub-Committee of Experts on the Transport of Dangerous Goods (TDG) - UN/SCETDG/29/INF.22 - (Germany) – Classificaiton of 1-hydroxybenzotriazole, anhydrous (HOBt), under a division of Class 1.
Kategorien:- Explosionsgefährlicher Stoff
- Stickstoffhaltiger Heterocyclus
- Aromat
Wikimedia Foundation.