- Tracleer
-
Strukturformel 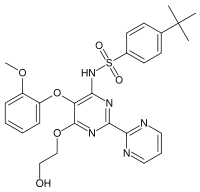
Allgemeines Freiname Bosentan Andere Namen 4-tert-Butyl-N-[6-(2-hydroxyethoxy)- 5-(2-methoxyphenoxy)-2-(pyrimidin-2-yl)pyrimidin-4-yl] benzolsulfonamid
Summenformel - C27H29N5O6S (Bosentan)
- C27H28N5NaO6S (Bosentan·Natriumsalz)
CAS-Nummer - 147536-97-8 (Bosentan)
- 147536-97-8 (Bosentan·Natriumsalz)
PubChem 104865 ATC-Code C02KX01
DrugBank APRD00829 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Endothelin wird von seinen ETA- und ETB-Rezeptoren verdrängt, daraus folgt eine Gefäßdilatation und eine (pulmonale) Blutdrucksenkung
Fertigpräparate Verschreibungspflichtig: Ja Eigenschaften Molare Masse 551,62 g·mol−1 Schmelzpunkt 195−198 °C [3]
Sicherheitshinweise Gefahrstoffkennzeichnung [4] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bosentan ist ein Endothelin-Rezeptorantagonist und ist wie Ambrisentan und Sitaxentan als so genannter Orphan Drug zur Behandlung der seltenen pulmonalen Hypertonie (Lungenbluthochdruck) der funktionellen WHO Klasse III zugelassen. [1]
Inhaltsverzeichnis
Pharmakologie
Wirkmechanismus und weitere Anwendungsgebiete
Bosentan verdrängt als Antagonist das Endothelin-1, das stärkste bekannte körpereigene Blutgefäßkonstringenz, von seinen Rezeptoren (ET1A- und ET1B-Rezeptoren) und hebt damit die Endothelin-1-Wirkung auf, so dass die Gefäße dilatieren und so dem durch das Endothelin verursachten Anstieg des (pulmonalen) Blutdrucks entgegengewirkt wird und es zu einer (pulmonalen) Blutdrucksenkung kommt. Außerdem wird so die durch das Endothelin verursachte Veränderung der Blutgefäße das (Remodelling) vermindert. [5]
Die Substanz wird neuerdings auch bei Sklerodermie eingesetzt[1], da umfassende Studien positive Ergebnisse zur Verhinderung von offenen Stellen, z. B. an den Fingerkuppen erbracht haben.
Nebenwirkungen
Flush-Symptomatiken, Ödeme und Hypotonie sind bisher als Folge des Eingriffs in die Blutdruckregulation als Nebenwirkungen dokumentiert. Unspezifische Nebenwirkungen, wie Kopfschmerzen, Müdigkeit und Juckreiz können ebenso wie Störungen im Magen-Darm-Trakt (Dyspesie und Refluxkrankheit) auftreten. Häufiger kann zu Leber-Transaminasen-Erhöhungen kommen, so dass regelmäßige Blutkontrollen notwendig sind.
Wechselwirkungen und Kontraindikationen[1]
Als Kontraindikationen gelten:
- Schwangerschaft - aufgrund einer Reproduktionstoxizität
- Leberzirrhosen mit einem Child-Pugh-Score der Klassen B und C
- andere Leberfunktionsstörungen mit erhöhten Leber-Transaminase-Werten[6]
Aufgrund der Wechselwirkung mit Ciclosporin A über einen CYP3A4-Mechanismus gilt die gleichzeitige Verabreichung von Bosentan und Ciclosporin A ebenfalls als Kontraindikation, denn dabei kann es zu 3-4fachen Plasmakonzentrationen an Bosentan und zu einer Halbierung der Plasmakonzentration von Ciclosporin A kommen.
Wirkstärken und Dosierung[1]
Das Präparat ist in den Wirkstärken 62,5 mg und 125 mg verfügbar.
Bei einem Erwachsenen wird die Therapie sowohl bei der pulmonalen Hypertonie als auch bei der Sklerodermie mit zweimal täglich 62,5 mg über einen Zeitraum von 4 Wochen begonnen und dann auf die standardmäßige Erhaltungsdosis von zweimal 125 mg täglich gesteigert.
Handelsnamen
In Deutschland und Österreich wird das wird von der Firma Actelion hergestellte Bosentanpräparat unter dem Handelsnamen Tracleer® vermarktet.[1][2]
Einzelnachweise
- ↑ a b c d e f ABDA-Datenbank (Stand 17.07.2008) der DIMDI
- ↑ a b Austria-Codex (Stand 17.07.2008)
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 221, ISBN 978-0-911910-00-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Pharmazeutische Zeitung Nr. 27 vom 03.07.2008, S. 24 ff.
- ↑ EMEA: Einschränkungen und Bedingungen für die Verwendung von Tracleer
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
