- Bariumtitanat
-
Kristallstruktur 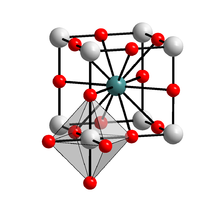
__ Ba2+ __ Ti4+ __ O2− Allgemeines Name Bariumtitanat Verhältnisformel BaTiO3 CAS-Nummer 12047-27-7 Kurzbeschreibung weißes bis graues, geruchloses Pulver[1]
Eigenschaften Molare Masse 233,19 g·mol−1 Aggregatzustand fest
Dichte 5,85 g·cm−3[1]
Schmelzpunkt Löslichkeit unlöslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 302-332 EUH: keine EUH-Sätze P: keine P-Sätze [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/22 S: (2)-28 MAK 0,5 mg·m−3 Barium[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumtitanat ist ein Mischoxid von Barium und Titan aus der Gruppe der Titanate und kristallisiert in der Perowskit-Struktur.
Inhaltsverzeichnis
Gewinnung und Darstellung
BaTiO3 kann nach der klassischen Mischoxid-Methode aus BaCO3 (Bariumcarbonat) und TiO2 (Titandioxid) in einer Festkörperreaktion, dem sogenannten Kalzinieren, bei einer Temperatur von 1200 °C hergestellt werden.
Moderatere Bedingungen bietet die Kristallisation aus schmelzflüssiger Lösung. Stöchiometrische Mengen Bariumcarbonat und Titandioxid (Anatas) werden mit einem großen Überschuss Natriumchlorid vermengt. Im Ofen kristallisiert bei 1.000 °C das Bariumtitanat aus. Nach Auswaschen der Salzreste erhält man es in sehr reiner Form, in feinen Kristallen.
Eigenschaften
Physikalische Eigenschaften
Bariumtitanat gehört zur Gruppe der Elektrokeramiken. Bariumtitanat ist ein Ferroelektrikum und besitzt eine ausgeprägte Hystereseschleife. Wie alle Ferroelektrika besitzt es eine hohe Dielektrizitätskonstante von über 2.000. Bariumtitanat kristallisiert in zwei polymorphen Gitter-Typen, dem hexagonalen Gitter-Typ und der Perowskit-Struktur. Bei Temperaturen < 120 °C liegt es als tetragonal verzerrte Modifikation der Perowskit-Struktur vor, bei der das Titanion gegenüber den Sauerstoffionen in z-Richtung verschoben ist. Daraus resultieren ein Dipolmoment der Elementarzelle und die Polarisation. Bei 120 °C erfolgt die Phasenumwandlung zur kubischen Perowskit-Struktur, bei der sich das Titanion genau im Zentrum des Oktaeders aus Sauerstoffionen befindet. Damit hat die Elementarzelle des Kristalls kein Dipolmoment mehr und der Kristall ist nicht mehr ferroelektrisch. Bei hohen Temperaturen erfolgt die Phasenumwandlung in die hexagonale Phase. Diese Phasenumwandlung erfordert eine umfangreichere Umordnung der Ionen als der Übergang bei 120 °C. Bei größeren Kristallen kommt es deshalb häufig vor, dass sie bei dieser Umwandlung zerbrechen.
Verwendung
Aufgrund der ferroelektrischen, dielektrischen und pyroelektrischen Eigenschaften findet Bariumtitanat sowie verwandte Perowskite wie Pb(Zr,Ti)O3 vielseitige Anwendung in der Elektronik und Sensorik. Als Beispiel seien hierzu Kaltleiter, sowie die Verwendung als Dielektrikum in Kondensatoren, insbesondere in Keramikkondensatoren erwähnt.
Einzelnachweise
- ↑ a b c d e Datenblatt Bariumtitanat bei AlfaAesar, abgerufen am 7. Januar 2010 (JavaScript erforderlich)..
- ↑ a b Datenblatt Bariumtitanat bei Sigma-Aldrich, abgerufen am 9. März 2011.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bariumsalze“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
Literatur
- Arthur R. von Hippel: Ferroelectricity, Domain Structure, and Phase Transitions of Barium Titanate. In: Rev. Mod. Phys. 1950, 22, S. 221–237, doi:10.1103/RevModPhys.22.221.
Kategorien:- Gesundheitsschädlicher Stoff
- Oxidkeramik
- Bariumverbindung
- Titanverbindung
- Elektrotechnischer Werkstoff
Wikimedia Foundation.

