- Zinkelektrolyte
-
Zinkelektrolyte gehören zu den wichtigsten Elektrolyttypen der Galvanotechnik. Das Element Zink gehört mit einem Gleichgewichtspotenzial Zn/Zn2+ = −0,763 V zu den relativ unedlen Metallen. Zink ist im sauren und im alkalischen Bereich löslich; deshalb konnten sowohl saure als auch alkalische Elektrolyttypen entwickelt werden.
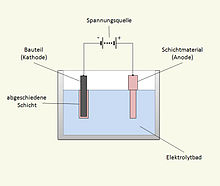
Elektrochemische Abscheidung von Zink
Elektrolytisch abgeschiedene Zinkschichten haben eine metallisch-bläulich-weiße Farbe. Wenn die Zinkschicht einen hohen Glanzgrad hat, besteht eine Verwechslungsgefahr mit Chromüberzügen. Oft wird die Farbe von elektrolytisch verzinkten Teilen nachträglich durch eine Passivierung verändert (bläulich, irisierend, gelb, schwarz). Kleinteile aus Stahl oder Zinkdruckguss werden als Schüttgut in einer Trommel verzinkt, mittelgroße oder dekorativ besonders anspruchsvolle Teile werden zum Verzinken auf ein Gestell aufgesteckt. Das zu verzinkende Werkstück wird als Kathode geschaltet; im Gleichstrom bei etwa 0,5–4,0 A/dm2 scheidet sich dann eine feinkristalline Zinkschicht auf der Oberfläche ab.
Weiterhin können in kontinuierlichen elektrolytrischen Verzinkungsanlagen Stahlbänder (Bandstahl) für anspruchsvolle Anwendungen (Automobil, Hausgeräteindustrie) verzinkt werden (etwa mit dem Gravitel-Verfahren).
Zinkelektrolytetypen
Nach ihrer Elektrolytzusammensetzung unterscheidet man
- schwachsaure Zinkelektrolyte (das Leitsalz ist üblicherweise Kaliumchlorid, der pH-Wert wird mit Borsäure gepuffert)
- hochcyanidhaltige Zinkelektrolyte auf der Basis von Kalium- oder Natriumcyanid und Hydroxid (der Cyanidgehalt liegt etwa zwischen 75 und 150 g/l)
- cyanidarme Zinkelektrolyte (der Cyanidgehalt liegt etwa zwischen 10 und 30 g/l)
- alkalische (cyanidfreie) Zinkelektrolyte (das Leitsalz ist Natrium- oder Kaliumhydroxid)
Schwachsaure und cyanidfreie Elektrolyte stellen besonders hohe Anforderungen an die Vorbehandlung der Oberfläche, während cyanidhaltige Elektrolyte (besonders im Trommelverfahren) mit einer einfachen Abkochentfettung auskommen.
Die Badführung muss bei den schwachsauren und cyanidfreien Elektrolyten besonders präzise sein, während die cyanidhaltigen (besonders die hochcyanidhaltigen) Elektrolyte in einem weiten Bereich der chemischen Konzentration, der Stromdichte und der Badtemperatur zufriedenstellend arbeiten.
Bei der Zinkabscheidung in cyanidhaltigen Elektrolyten entsteht viel Wasserstoff. Besonders bei Stählen mit höherer Festigkeit kommt es durch den Wasserstoff zur Versprödung, die durch nachträgliches Tempern wieder beseitigt werden muss. Bei Teilen, die besonders anfällig gegen Versprödung sind, wird aus diesem Grund oft der saure Elektrolyttyp gewählt.
Von den verschiedenen Elektrolyten hat der hochcyanhaltige Typ die beste Streufähigkeit und der saure Typ die schlechteste. Dementsprechend hätte ein Bauteil nach der sauren Verzinkung die größten Schichtdickenunterschiede an verschiedenen Stellen der Oberfläche.
Die höchste Abscheidegeschwindigkeit lässt sich mit dem schwachsauren Elektrolyten erreichen.
Die cyanidischen Badtypen stellen besondere Anforderungen an die Abwasserbehandlung (Entgiftung) und die Arbeitssicherheit (Umgang mit giftigen Stoffen).
Für viele galvanischen Verzinkungsverfahren gilt, dass sie organische Additive benötigen, damit sich nicht eine pulvrig-schwarze, sondern eine haftfeste und glänzende Schicht bildet. Diese Glanzzusätze sind polare Substanzen, die sich im elektrischen Feld auf der Oberfläche anlagern und dort als Inhibitoren wirken, also das Kristallwachstum hemmen und so sehr feinkristalline Strukturen erzeugen. Im schwachsauren Elektrolyten werden zusätzlich Tenside benötigt, die die Oberfläche benetzen und die Glanzzusätze emulgieren.
Für die Verzinkung von Bandstahl werden saure Sulfatelektrolyte verwendet, die mit oder ohne Additiv betrieben werden.
Wikimedia Foundation.