- Kaliumchlorid
-
Kristallstruktur 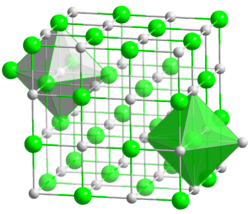
__ K+ __ Cl− Kristallsystem kubisch
Raumgruppe 
Koordinationszahlen K[6], Cl[6]
Allgemeines Name Kaliumchlorid Andere Namen - Sylvin (Mineral)
- Chlorkalium (hist.)
- Digestivsalz (hist.)
- Kalium chloratum (latinisiert)
Verhältnisformel KCl CAS-Nummer 7447-40-7 PubChem 4873 ATC-Code Kurzbeschreibung farb- und geruchsloser Feststoff[1]
Eigenschaften Molare Masse 74,55 g·mol−1 Aggregatzustand fest
Dichte 1,98 g·cm−3[1]
Schmelzpunkt Siedepunkt 1500 °C (Sublimation)[1]
Dampfdruck Löslichkeit gut (330 g·l−1 bei 20 °C) in Wasser[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.  Werk in der Wüste Lop Nor zur Herstellung von jährlich 1,2 Millionen Tonnen Pottasche-Dünger aus sylvinitischem Kalisalz (Satellitenbild von 2009).
Werk in der Wüste Lop Nor zur Herstellung von jährlich 1,2 Millionen Tonnen Pottasche-Dünger aus sylvinitischem Kalisalz (Satellitenbild von 2009).
Kaliumchlorid (Sylvin), KCl, das Kaliumsalz der Salzsäure, bildet farblose, salzig-bitter schmeckende, wasserlösliche Kristalle mit einem Schmelzpunkt von 773 °C[2] und einer Dichte von 1,98 g/cm3. Es löst sich bei 20 °C zu 350 g·l−1 in Wasser.[3]
Inhaltsverzeichnis
Vorkommen
Weltweit gibt es zahlreiche kaliumchloridhaltige Salzvorkommen. Von herausragender Bedeutung sind die Vorkommen in Kanada, in der GUS und Deutschland. Bis 2014 wird das über 240 Millionen Tonnen große Vorkommen in der Wüste Lop Nor im Seebecken von Lop Nor in China mit der weltgrößten Produktionsstätte für 3 Millionen Tonnen Dünger erschlossen.[4]
Kaliumchloridhaltige Minerale und Gesteine
- Sylvin (Sylvit) - KCl
- Carnallit - KCl · MgCl2 · 6 H2O
- Kainit - KCl · MgSO4 · 3 H2O
- Gestein Sylvinit - KCl · NaCl
Gewinnung
- Auskristallisieren des schwerer löslichen Kaliumchlorids beim Eindampfen von konzentrierten Carnallit-Lösungen (KMgCl3 · 6 H2O) (Dieses Verfahren hat technisch die größte Bedeutung.)
- Durch Flotation von kaliumchloridhaltigen Salzgemengen, z.B. im Kalibergbau gewonnener Rohsalze.
- Durch das Heißlöseverfahren: selektives Herauslösen des KCl aus Salzgemengen auf Grund unterschiedlicher Temperaturabhängigkeiten der Löslichkeiten von Salzen.
- Durch elektrostatische Trennung aus Salzgemengen, ESTA-Verfahren.
- Neutralisiation von Salzsäure und Kalilauge HCl + KOH
 H2O + KCl
H2O + KCl
Verwendung
- Dünger
- Geschmacksverstärker: Lebensmittelzusatz E 508
- Härtesalz in der Metallindustrie
- Streusalz (wegen der tieferen Schmelztemperatur einer Kaliumchlorid-Wasser-Mischung ist es auch bei Temperaturen unter −10 °C wirtschaftlich einsetzbar).
- Rohstoff für die Herstellung fast aller Kaliumverbindungen (beispielsweise Kaliumcarbonat, Kaliumhydroxid) und auch der Legierung NaK.
- Bestandteil künstlich hergestellter physiologischer Lösungen
- Elektrolyt- und Aufbewahrungslösung für pH-Messelektroden und Redox-Elektroden (annähernd gesättigt mit 3 mol/l KCl-Lösung). Durch die gleiche Ionenbeweglichkeit von Kalium- und Chloridionen ist diese Lösung potentialneutral.
- Kalibrierstandard für Betastrahlung. Kalium enthält zu 0,0118 % das Isotop 40K, dieses liefert 16350 Bq pro Kilogramm KCl, davon sind 89,28 % Betastrahlung und 10,72 % Gammastrahlung mit 1,46083 MeV.
- Schwebemittel in der Emailleindustrie
- Bestandteil in schmerzhemmenden Zahncremes (bei schmerzempfindlichen Zähnen)
- In der Erdölindustrie zur Stimulation von Lagerstätten.
- Die Injektion von hohen Dosen Kaliumchlorid kann zum Herzstillstand durch Hyperkaliämie führen. Dies wird beim Einschläfern von Tieren, bei der Hinrichtung durch die Giftspritze und zur Verhinderung von Lebendgeburten bei späten Schwangerschaftsabbrüchen ausgenutzt.
Nachweis
- Klassisch: Nachweis des Cl−-Ions durch Fällung mit Ag+, Pb2+ oder Hg2+ als Silberchlorid AgCl, Blei(II)-chlorid PbCl2 sowie als Quecksilberchlorid (Kalomel) HgCl.
- Nachweis des K+-Ions über die violette Flammenfärbung beziehungsweise Fällung mit ClO4− möglich.
- Modern: Nachweis der Elemente zum Beispiel mittels Atomabsorptionsspektroskopie
- Als Gift im menschlichen Körper gehört Kaliumchlorid zu den am schwersten nachzuweisenden Giften, die derzeit bekannt sind.
Pathologie und Forensik
In der Forensik der Toxikologie kann eine Vergiftung mit Kaliumchlorid meist nur indirekt nachgewiesen werden, da der natürliche Spiegel nach dem Tod auf die zwei- bis dreifache Konzentration ansteigt. Bei Todesursache durch Herzrhythmusstörung bzw. -versagen ist die Unversehrtheit des Herzens ein Indiz für Vergiftung, da ein Herzinfarkt dann ausscheidet. Ein weiteres Indiz sind Einstichstellen, durch die das Kaliumchlorid injiziert werden konnte. Da bei stationären Krankenhauspatienten häufig Zugänge durch Venenverweilkanülen gelegt werden, um auch andere Medikamente zu verabreichen, scheidet diese Analyse für diese Gruppe eher aus. Darüber hinaus besteht noch die Möglichkeit einer statistischen Analyse: sterben besonders viele Patienten eines bestimmten Gesundheits- und Krankenpflegers oder Arztes, kann es als lohnend erscheinen, die Patienten nach obigen Kriterien genauer zu untersuchen.
Weblinks
Einzelnachweise
- ↑ a b c d e f Eintrag zu Kaliumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. August 2007 (JavaScript erforderlich).
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; ISBN 978-0-911910-00-1.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ World's largest potash fertilizer project operational in China
KaliumhalogenideKaliumfluorid | Kaliumchlorid | Kaliumbromid | Kaliumiodid
Wikimedia Foundation.
