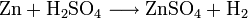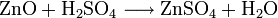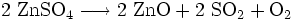- ZnSO4
-
Strukturformel Zn2+ + 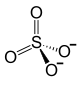
Allgemeines Name Zinksulfat Andere Namen - Zink(II)-sulfat
- Zinkvitriol
Summenformel ZnSO4
ZnSO4 · 7 H2OCAS-Nummer 7733-02-0 (wasserfrei)
7446-20-0 (Heptahydrat)PubChem 24424 ATC-Code A12CB01
Kurzbeschreibung weißes, wasserlösliches Pulver Eigenschaften Molare Masse 161,45 g·mol−1 (wasserfrei)
287,53 g·mol−1 (Heptahydrat)Aggregatzustand fest
Dichte Schmelzpunkt 100 °C (Heptahydrat)[1]
Siedepunkt Zersetzung: 740 °C[1]
Löslichkeit löslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-41-50/53 S: (2)-22-26-39-46-60-61 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln WGK 3 (stark wassergefährdend)[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinksulfat (ZnSO4) ist das Zinksalz der Schwefelsäure (Trivialnamen: schwefelsaures Zinkoxid, weißer Vitriol, Kupferrauch, weißer Galitzenstein, Augenstein, als Mineral: Goslarit). Es bildet farblose Kristalle, in wasserfreier Form ist es ein weißes Pulver.
Inhaltsverzeichnis
Gewinnung und Darstellung
Es wird hergestellt durch Auflösen von Zink oder Zinkoxid in verdünnter Schwefelsäure:
Man kann es auch durch Einwirkung von Zink auf die meisten Schwermetallsulfate gewinnen, wobei das Schwermetall in elementarer Form ausfällt. Beispiele hierfür sind:
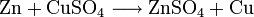 .
.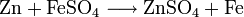 .
.
Es entsteht durch oxidative Verwitterung von Zinkblende (Zinksulfid, ZnS)
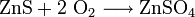 .
.
Das so entstandene Mineral ZnSO4 · 7 H2O wird als Goslarit bezeichnet.
Eigenschaften
Es zersetzt sich bei Temperaturen oberhalb von 740 °C:
Zinksulfat kristallisiert aus seinen wässrigen Lösungen als Zinkvitriol in farblosen, rhombischen Kristallen mit 7 Molekülen Wasser (ZnSO4 · 7 H2O). Es verliert beim Erhitzen seine Wasseranteile und zerfällt zu einem weißen Pulver. Zinksulfat zeigt in wässriger Lösung infolge teilweiser Hydrolyse eine schwach saure Reaktion. Beim Lösen des wasserfreien Salzes in Wasser tritt Erwärmung ein, beim Lösen von ZnSO4 · 7 H2O dagegen Abkühlung.
Es verwittert oberflächlich an der Luft durch Verlust von Kristallwasser und schmilzt beim Erwärmen in seinem Kristallwasser. Es verliert schon bei 39 °C ein Molekül Kristallwasser; bei 70 °C liegt nur noch ein Wassermolekül vor, das bei 240 °C) abgespalten wird[3].
Verwendung
Zinksulfat wird in der Färberei, zur Holzimprägnierung und zur Herstellung von Elektrolysezink verwendet. Auf Grund der bakterientötenden Wirkung von Zn2+-Ionen werden sehr verdünnte Lösungen von ZnSO4 (0,1–0,5 %) als Augenwasser bei Bindehautentzündungen eingesetzt.
Man benutzt Zinksulfat ferner:
- in der Kattundruckerei
- zum Konservieren von Holz und Häuten
- als Flammenschutzmittel
- als Zusatz zu Firnis, um das Öl schnell trocknend zu machen
- bei der Feuerversilberung
Nachweis
Natronlauge (NaOH) gibt mit Zinksulfat einen gallertartigen Niederschlag von Zinkhydroxid, der nach Befeuchten mit einer verdünnten Cobaltsalzlösung und Glühen das sogenannte Rinmans Grün ergibt.
Bariumchloridlösung bildet einen weißen Niederschlag von Bariumsulfat:
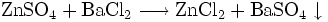
- Zinksulfat und Bariumchlorid reagieren zu Zinkchlorid und Bariumsulfat, das ausfällt.
Quellen
- ↑ a b c d e Eintrag zu Zinksulfat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 11. November 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7733-02-0 im European chemical Substances Information System ESIS
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
Wikimedia Foundation.