- Zoledronsäure
-
Strukturformel 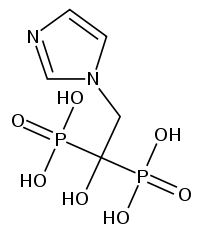
Allgemeines Freiname Zoledronsäure Andere Namen Summenformel C5H10N2O7P2 CAS-Nummer 118072-93-8 PubChem 68740 ATC-Code M05BA08
DrugBank DB00399 Kurzbeschreibung weißes kristallines Pulver [1] Arzneistoffangaben Wirkstoffklasse Fertigpräparate - Zometa® (EU, CH)
- Aclasta® (A, D, EU)
- Reclast® (USA)
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 272,09 g·mol−1 Sicherheitshinweise Gefahrstoffkennzeichnung
unbekanntR- und S-Sätze R: ? S: ? Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zoledronat (INN Zoledronsäure) gehört zu den Arzneistoffen, welche die Knochen schützen (so genannte Bisphosphonate). Es handelt sich hierbei um ein Pyrophosphat-Analogon, das von der Struktur her der Pamidronsäure ähnelt. Seit Anfang 2001 wird der Arzneistoff durch Novartis unter dem Handelsnamen Aclasta® vermarktet und seit 2005 zur Behandlung des Osteodystrophia deformans eingesetzt. Seit Oktober 2007 gibt es eine europäische Zulassung zur Behandlung der Osteoporose.
Inhaltsverzeichnis
Wirkung
Zoledronsäure wird im Gegensatz zu anderen Bisphosphonaten einmal jährlich intravenös - und nicht wie sonst üblich in Form von wöchentlicher Tabletteneinnahme - verabreicht. Durch Zoledronsäure wird der Knochenabbau vermindert, indem die Osteoklasten gehemmt werden. Die Osteoklasten sind für die Resorption der Knochensubstanz verantwortlich. Über diesen Mechanismus können gutartige metabolische Knochenerkrankungen behandelt werden.
Aclasta® wird gegen Osteoporose und Osteodystrophia deformans eingesetzt. Die Osteodystrophia deformans ist nach Osteoporose die zweithäufigste Erkrankung des Knochenstoffwechsels. Sie äußert sich durch die Verdickung und Deformierung von Knochen und eine verminderte Bruchfestigkeit. Die Ursache ist nicht abschließend geklärt - man nimmt virale Infektionen oder genetische Faktoren an. In der im Mai 2007 im New England Journal of Medicine veröffentlichten HORIZON-RFT Studie mit 7765 Patientinnen mit postmenopausaler Osteoporose konnte über drei Jahre unter Zoledronsäure 5 mg das Risiko für Wirbelkörperfrakturen im Vergleich mit Placebo um 70 % und das Risiko für Hüftfrakturen um 41 % reduziert werden. Eine Durchstechflasche Aclasta® enthält 5 Milligramm Wirkstoff, in 100 ml Wasser für Injektionszwecke. Die Applikation erfolgt einmal jährlich als Infusion.[2]
Erweiterte Indikation
Die Europäische Kommission hat auf der Basis der wissenschaftlichen Beurteilung der EMEA für Zoledronat eine erweiterte Zulassung für die EU, Island und Norwegen erteilt. Neu können auch Männer, welche aufgrund einer Osteoporose ein erhöhtes Frakturrisiko aufweisen, mit Zoledronat behandelt werden. Die Zulassungserweiterung umfasst auch die Reduktion von Frakturen bei Männern und postmenopausalen Frauen, welche kürzlich eine osteoporosebedingte Hüftfraktur erlitten haben. Letztgenannte Indikationserweiterung stützt sich auf eine klinische Studie mit 2100 PatientInnen. Gemäß diesen Studiendaten kann das Risiko für eine erneute Fraktur um 35 % gesenkt werden.[3][4]
Nebenwirkungen
Die Nebenwirkungen von Zoledronat oder Zoledronsäure sind vergleichbar mit denen anderer i.v. Bisphosphonate. Sie treten in der Regel innerhalt der ersten Tage nach der Einnahme auf und klingen innerhalb weniger Tage wieder ab. Als häufigste Nebenwirkungen sind grippeähnliche Symptome zu beobachten. Außerdem kann es in Einzelfällen zu Fieber, Knochen- und Gelenkschmerzen, Müdigkeit, Magen-Darm-Beschwerden kommen. Laut der sogenannten HORIZON-Studie trat bei Behandlung mit Zoledronsäure bei nicht wenigen Patientinnen (1,3 %) auch Vorhofflimmern auf, das bisher bei Bisphosphonaten nicht beobachtet worden war.[5]. Das Vorhofflimmern lag unter der für diese Altersgruppe zu erwartenden Rate und wurde in anderen Studien mit Zoledronsäure nicht beobachtet.
Studien
- Zoledronic Acid and Clinical Fractures and Mortality after Hip Fracture Published at www.nejm.org September 17, 2007
Einzelnachweise
- ↑ FDA - Full prescribing information for Zometa® (PDF)
- ↑ Black et al.. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. NEJM 2007;356;18;1809-1822. Abstract
- ↑ Once-yearly Aclasta® approved in EU to treat osteoporosis in men and to reduce risk of new fractures following hip fracture both in men and postmenopausal women Novartis Pressemitteilung vom 30. September 2008 (PDF)
- ↑ Lyles KW et al.:Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007 Nov 1;357(18):1799-809. Epub 2007 Sep 17. Volltext (HTML)Volltext (PDF) PMID 17878149
- ↑ Ergebnis der randomisierten HORIZON-Studie veröffentlicht im New England Journal of Medicine (NEJM 2007; 356:1809-1822), hier zitiert nach: Deutsches Ärzteblatt, 3. Mai 2007 [1]
Weblinks
- Aclasta®: Zusammenfassung der Merkmale des Arzneimittels, Stand: Oktober 2008 auf der Website der Europäischen Arzneimittelagentur EMEA
- Zometa®: Zusammenfassung der Merkmale des Arzneimittels, Stand: Oktober 2008 auf der Website der Europäischen Arzneimittelagentur EMEA
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
