- Bergman-Cyclisierung
-
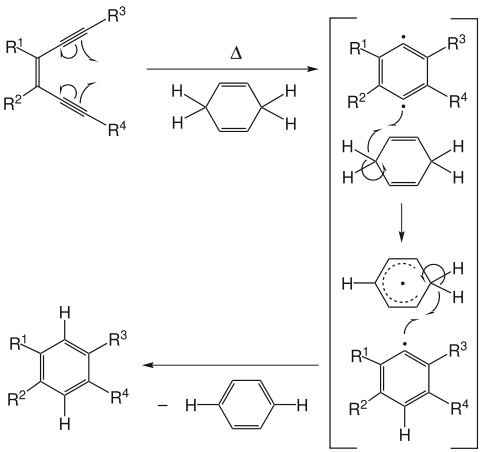
Die Bergman-Cyclisierung (fachsprachlich) bzw. Bergman-Zyklisierung ist eine Reaktion aus dem Bereich der organischen Chemie. Es handelt sich hierbei um eine thermische Umlagerung mit kurzlebigen radikalischen Zwischenprodukten. Benannt wurde sie nach ihrem Entdecker Robert George Bergman, der sie erstmals 1972 publizierte. Die Reaktion dient der Synthese von Benzolderivaten aus konjugierten Endiinen in Gegenwart von Wasserstoffdonoren.[1]
Die Bergman-Cyclisierung erklärt unter anderem den Wirkmechanismus von Endiin-Antibiotika. Dort insertiert das radikalische Intermediat in die DNA.
Mechanismus
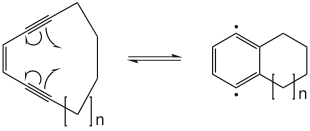
Als Wasserstoffdonor wird praktischerweise oft (wie im Beispiel oben) 1,4-Cyclohexadien eingesetzt, das durch Abgabe von zwei Wasserstoffradikalen zu Benzol umgesetzt wird. Dieses greift nicht weiter in die Reaktion ein. Je weiter die Dreifachbindungen räumlich voneinander entfernt sind, desto höher ist die nötige Temperatur; bei terminalen Alkinen kann die Temperatur über 200°C liegen. Alkine, die schon eine cyclische Präorientierung besitzen, können meist bei wesentlich niedrigeren Temperaturen zur Reaktion gebracht werden. Um Cyclisierung bei physiologischen Temperaturen zu erreichen, sollte die Endiin-Einheit Teil eines Zehnrings sein (n=1 im Beispiel unten).[2]
Einzelnachweise
- ↑ Richard R. Jones, Robert G. Bergman: p-Benzyne. Generation as an intermediate in a thermal isomerization reaction and trapping evidence for the 1,4-benzenediyl structure. In: Journal of the American Chemical Society. Band 94, Nr. 2, 1972, S. 660–661.
- ↑ László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
Literatur
- Jie Jack Li: Name reactions: a collection of detailed reaction mechanisms. Springer Berlin Heidelberg New York 2006, ISBN 978-3-540-30030-4 (Eingeschränkte Vorschau in der Google Buchsuche), S. 49.
Wikimedia Foundation.