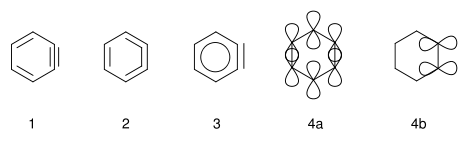
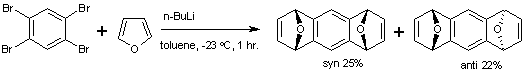- Didehydrobenzen
-
Ein Arin ist ein ungeladenes, reaktives Zwischenprodukt, derivatisiert aus einem aromatischen System, in dem zwei orthoständige Substituenten abgespalten werden und dabei zwei Atomorbitale mit zwei Elektronen, die auf beide verteilt sind, hinterlassen.[1]. In Analogie zu Carbenen und Nitrenen hat das Arin einen Singulett- und einen Triplettzustand.
Inhaltsverzeichnis
Grundlagen
Das einfachste Arin, C6H4 (mit 1 im rechten Bild bezeichnet), wird oft in Anlehnung an die englische Bezeichnung, Benzyne genannt. Jedoch muss diese Bezeichnung kritisch betrachtet werden, da es eine Dreifachbindung impliziert, die eine spezielle Dreifachbindung wäre. Ein besserer Name ist Didehydrobenzene. Benzyne ist resonanzstabilisiert, wie die Strukturen 1 und 2 zeigen. Die tatsächliche Verteilung der Elektronen ist aus 3 besser ersichtlich. Die zusätzliche π-Bindung (4) ist lokalisiert und steht orthogonal zur π-Bindung (4a), die am aromatischen System beteiligt ist. Benzyne kann auch als Diradikal bezeichnet werden: die π-Bindung 4b ist homolytisch gespalten, wobei je ein Elektron bei dem Atom steht, das vorher an der Bindung beteiligt war.
Benzyne ist aufgrund der Dreifachbindung äußerst reaktiv. Normalerweise stehen in Alkinen (im einfachsten Fall Ethin) die unhybridisierten p-Orbitale orthogonal nach oben und hinten zur Molekülachse. Das bewirkt eine optimale Überlappung der Orbitale. Im Arin wird das p-Orbital jedoch verzerrt, um die Dreifachbindung im Ringsystem unterzubringen. Dadurch verringert sich die optimale Überlappung der Orbitale.
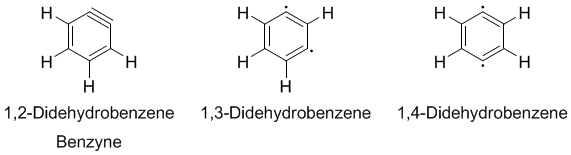
Es gibt drei mögliche Diradikale des Didehydrobenzenes: 1,2-, 1,3- und 1,4-Didehydrobenzene. Die Bindungsenergien sind in silico 106, 122, and 138 kcal/mol (444, 510, and 577 kJ/mol)[2]. Das 1,4-Diradikal wurde anhand der Bergman-Cyclisierung bewiesen. Professor Maitland Jones (Princeton University) hat die möglichen Umlagerungen der 1,2-, 1,3- und 1,4-didehydrobenzene untersucht.[2][3]
Chemie der Arine
Arine werden größtenteils aus Arylhaliden in Gegenwart starker Basen dargestellt. Der bekannteste Weg zur Darstellung der Arine ist die Diels-Alder-Reaktion aus Dienen. Tetrabromobenzene reagiert mit Butyllithium und Furan zu Tetrahydroanthracene [4]. Die syn- und anti-Stereoisomere können aufgrund der unterschiedlichen Löslichkeiten mit Methanol getrennt werden.
Anthracen wird zu Triptycene durch Diels-Alder-Reaktion eines Arins mit dem zentralen Benzolring umgewandelt.[5]. Das Pentiptycene ist das Anthracene-Aanaloge bei der Reaktion mit 1,2,4,5-Tetrabromobenzene und Butyllithium.
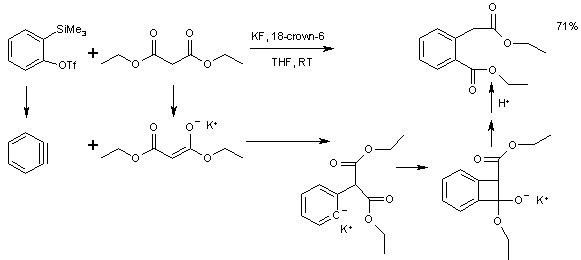
Die Arinreaktivität kann auch auf Insertionsreaktionen an Stoffen angewandt werden, die sowohl nucleophil als auch elektrophil reagieren können, so z. B. Malonsäureester[6]. Die Vorstufe des Benzyne in dieser Reaktion ist 2-(trimethylsilyl)Phenyltriflat.
Didehydrobenzene Umwandlungen
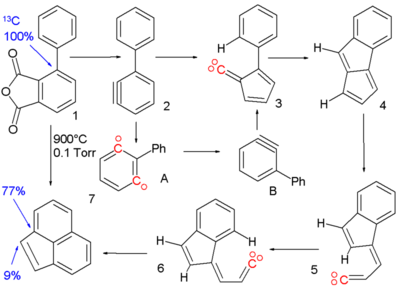
Die Reaktion von 1,2- zu 1,3-Didehydrobenzene wurde postuliert, um die Pyrolyse (900°C) der phenylsubstituierten Arinvorstufe 1 [2] zu Acenaphthylen 7 zu erklären.
Die Reaktion verläuft über mehrere, reaktive Zwischenprodukte: Das Arin 2 wird aus phenylsubstituiertem Phthalsäureanhydrid dargestellt und lagert sich unter Ringkontraktion zum Vinyliden 3 um. Das entstandene Carben erfährt eine C-H-Insertionsreaktion zu Pentalene 4 und anschließender Spaltung einer Bindung zu Vinyliden 5. Nach cis-trans-Isomerisation zu 6 folgt eine letzte Insertionsreaktion zur Bildung des Acenaphthylene. Der Beweis der Phenylmigration in Arin 2 aus dem 1,2-Didehydrobenzene zum 1,3-Didehydrobenzene basiert auf Isotopenwanderung. Wird das ipso-Kohlenstoffatom durch ein 13C in der Zwischenstufe ersetzt, findet man es bei dem gezeigten Mechanismus im Acenaphthylene an der ipso-Areneposition wieder. Die Anwesenheit des 13C in der Brückenposition kann nur erklärt werden, wenn 15% von 2 zu 1,3-Didehydrobenzene A isomerisieren.
Möglichkeiten
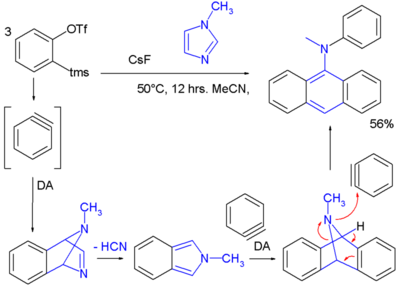
Die Chemie der Arine wurde angewandt, um neuartige Arylamine in einer Tandem-Reaktion einschließlich zweier Diels-Alder-Reaktionen mit drei Benzynemolekülen, die zu einem Imidazol reagieren, zu synthetisieren[7]:
Einzelnachweise
- ↑ Gilchrist T.C.; Rees C.W.; (1969) Carbenes, Nitrenes and Arynes Nelson. London.
- ↑ a b c A m-Benzyne to o-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Blake, M. E.; Bartlett, K. L.; Jones, M. Jr. J. Am. Chem. Soc. 2003, 125, 6485. doi:10.1021/ja0213672
- ↑ A p-Benzyne to m-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Completion of the Benzyne Cascade, Polishchuk, A. L.; Bartlett, K. L.; Friedman, L. A.; Jones, M. Jr. J. Phys. Org. Chem. 2004, Volume 17, Issue 9 , Pages 798 - 806. doi:10.1002/poc.797
- ↑ Organic Syntheses, Coll. Vol. 10, p.678; Vol. 75, p.201 Article
- ↑ Iptycenes, cuppedophanes and cappedophanes Harold Hart Pure & App Chem, Vol. 65, No. 1, pp. 27-34, 1993. Article
- ↑ Facile insertion reaction of arynes into carbon–carbon -bonds Hiroto Yoshida, Masahiko Watanabe, Joji Ohshita and Atsutaka Kunai, Chem. Commun., 2005, (26), 3292 Abstract
- ↑ A New Tandem Reaction of Benzyne: One-Pot Synthesis of Aryl Amines Containing Anthracene Chunsong Xie and Yuhong Zhang Org. Lett.; 2007; 9(5) pp 781 - 784; (Letter) doi:10.1021/ol063017g
Siehe auch
Wikimedia Foundation.