- Arine
-
Ein Arin ist ein ungeladenes, reaktives Zwischenprodukt, das aus einem aromatischen System entsteht, in dem zwei orthoständige Substituenten abgespalten werden und dabei zwei Atomorbitale mit zwei Elektronen, die auf beide verteilt sind, hinterlassen.[1] In Analogie zu Carbenen und Nitrenen hat das Arin einen Singulett- und einen Triplettzustand.
Inhaltsverzeichnis
Grundlagen
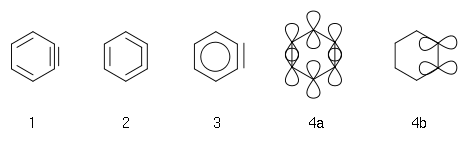
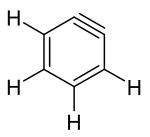
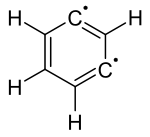
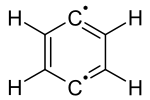
Das einfachste Arin, C6H4 (mit 1 im rechten Bild bezeichnet), wird manchmal in Anlehnung an die englische Bezeichnung, Benzyn genannt. Jedoch muss diese Bezeichnung kritisch betrachtet werden, da es eine Dreifachbindung impliziert, die eine spezielle Dreifachbindung wäre. Ein besserer Name ist Didehydrobenzen beziehungsweise Didehydrobenzol, meist kurz als "Dehydrobenzol" bezeichnet. Dehydrobenzol ist resonanzstabilisiert, wie die Strukturen 1 und 2 zeigen. Die tatsächliche Verteilung der Elektronen ist aus 3 besser ersichtlich. Die zusätzliche π-Bindung (4) ist lokalisiert und steht orthogonal zur π-Bindung (4a), die am aromatischen System beteiligt ist. Dehydrobenzol kann auch als Diradikal bezeichnet werden: die π-Bindung 4b ist homolytisch gespalten, wobei je ein Elektron bei dem Atom steht, das vorher an der Bindung beteiligt war.
Dehydrobenzol ist aufgrund der Dreifachbindung äußerst reaktiv. Normalerweise stehen in Alkinen (im einfachsten Fall Ethin) die unhybridisierten p-Orbitale orthogonal nach oben und hinten zur Molekülachse. Das bewirkt eine optimale Überlappung der Orbitale. Im Arin wird das p-Orbital jedoch verzerrt, um die Dreifachbindung im Ringsystem unterzubringen. Dadurch verringert sich die optimale Überlappung der Orbitale.
Es gibt drei mögliche Diradikale des Dehydrobenzols: 1,2-, 1,3- und 1,4-Didehydrobenzol. Die Bindungsenergien sind in silico 106, 122, and 138 kcal/mol (444, 510, and 577 kJ/mol)[2]. Das 1,4-Diradikal wurde anhand der Bergman-Cyclisierung bewiesen. Professor Maitland Jones (Princeton University) hat die möglichen Umlagerungen der 1,2-, 1,3- und 1,4-Didehydrobenzole untersucht.[2][3]
Chemie der Arine
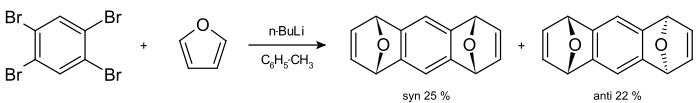
Arine werden größtenteils aus Arylhaliden in Gegenwart starker Basen dargestellt. Der bekannteste Weg zur Darstellung der Arine ist die Diels-Alder-Reaktion aus Dienen. 1,2,4,5-Tetrabrombenzol reagiert mit Butyllithium und Furan zu 1,4,5,8-Diepoxy-1,4,5,8-Tetrahydroanthracen [4]. Die syn- und anti-Stereoisomere können aufgrund der unterschiedlichen Löslichkeiten mit Methanol getrennt werden.
Anthracen wird durch Diels-Alder-Reaktion von Dehydrobenzol mit dem zentralen Benzolring zu Triptycen umgewandelt.[5]. Das Pentiptycen ist das Anthracen-Analoge bei der Reaktion mit 1,2,4,5-Tetrabromobenzol und Butyllithium.
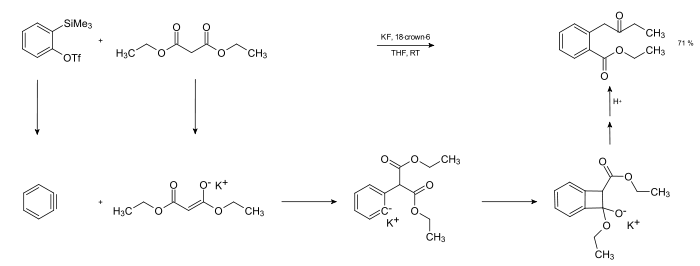
Die Arinreaktivität kann auch auf Insertionsreaktionen an Stoffen angewandt werden, die sowohl nucleophil als auch elektrophil reagieren können, so z. B. Malonsäureester[6]. Die Vorstufe des Dehydrobenzols in dieser Reaktion ist 2-(trimethylsilyl)Phenyltriflat.
Dehydrobenzol-Umwandlungen
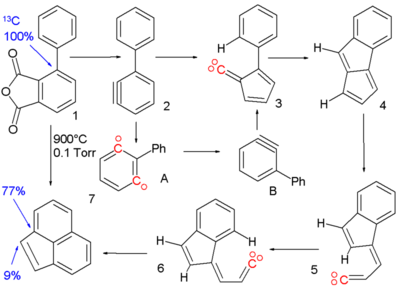
Die Reaktion von 1,2- zu 1,3-Didehydrobenol wurde postuliert, um die Pyrolyse (900°C) der phenylsubstituierten Arinvorstufe 1 [2] zu Acenaphthylen 7 zu erklären.
Die Reaktion verläuft über mehrere, reaktive Zwischenprodukte: Das Arin 2 wird aus phenylsubstituiertem Phthalsäureanhydrid dargestellt und lagert sich unter Ringkontraktion, d. h. Verkleinerung des Cyclohexa- auf den Cyclopenta-Ring, zum Vinyliden 3 um. Das entstandene Carben erfährt eine C-H-Insertionsreaktion zu Pentalen 4 und anschließender Spaltung einer Bindung zu Vinyliden 5. Nach cis-trans-Isomerisation zu 6 folgt eine letzte Insertionsreaktion zur Bildung des Acenaphthylens. Der Beweis der Phenylmigration im Arin 2 aus dem 1,2-Didehydrobenzol zum 1,3-Didehydrobenzol basiert auf Isotopenwanderung. Wird das ipso-Kohlenstoffatom durch ein 13C in der Zwischenstufe ersetzt, findet man es bei dem gezeigten Mechanismus im Acenaphthylen an der ipso-Arinposition wieder. Die Anwesenheit des 13C in der Brückenposition kann nur erklärt werden, wenn 15% von 2 zu 1,3-Didehydrobenzol A isomerisieren.
Möglichkeiten
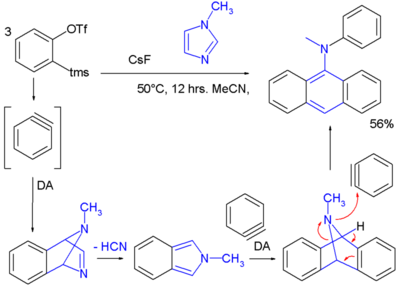
Die Chemie der Arine wurde angewandt, um neuartige Arylamine in einer Tandem-Reaktion einschließlich zweier Diels-Alder-Reaktionen mit drei Dehydrobenzolmolekülen, die zu einem Imidazol reagieren, zu synthetisieren[7]:
Einzelnachweise
- ↑ Gilchrist T.C.; Rees C.W.; (1969) Carbenes, Nitrenes and Arynes Nelson. London.
- ↑ a b c A m-Benzyne to o-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Blake, M. E.; Bartlett, K. L.; Jones, M. Jr. J. Am. Chem. Soc. 2003, 125, 6485, doi:10.1021/ja0213672.
- ↑ A p-Benzyne to m-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Completion of the Benzyne Cascade, Polishchuk, A. L.; Bartlett, K. L.; Friedman, L. A.; Jones, M. Jr. J. Phys. Org. Chem. 2004, 17, 798 - 806, doi:10.1002/poc.797.
- ↑ Organic Syntheses, Coll. Vol. 10, S. 678; Vol. 75, S. 201 Article.
- ↑ Iptycenes, cuppedophanes and cappedophanes Harold Hart Pure & App Chem 65, 27-34, 1993. Article.
- ↑ Facile insertion reaction of arynes into carbon–carbon -bonds Hiroto Yoshida, Masahiko Watanabe, Joji Ohshita and Atsutaka Kunai, Chem. Commun., 2005, 26, 3292 Abstract.
- ↑ Chunsong Xie, Yuhong Zhang: A New Tandem Reaction of Benzyne: One-Pot Synthesis of Aryl Amines Containing Anthracene Organic Letters; 2007, 9, 781 - 784, doi:10.1021/ol063017g.
Siehe auch
Wikimedia Foundation.