- Betalactamase
-
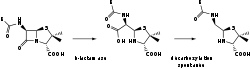
Β-Lactamase Bezeichner Gen-Name(n) bla Enzymklassifikation EC, Kategorie 3.5.2.6 Hydrolase Reaktionsart Hydrolyse Substrat β-Lactam + H2O Produkte β-substituierte Aminosäure Vorkommen Übergeordnetes Taxon Bakterien β-Lactamasen sind Enzyme, die von zahlreichen Bakterien gebildet werden. Zur Zeit sind mehr als 340 Varianten bekannt. Sie hydrolysieren den β-Lactam-Ring, ein gemeinsamer Bestandteil aller β-Lactam-Antibiotika und können diese somit inaktivieren. Damit spielen sie eine wichtige Rolle in der Antibiotikum-Resistenz von Bakterien. Die genetische Information zur Synthese des Enzyms wird chromosomal oder plasmidal vererbt. Je nach ihrer Wirkung unterscheidet man zwischen Penicillinasen und Cephalosporinasen.
Extended Spectrum β-Lactamasen
Extended Spectrum β-Lactamasen (ESBL) hingegen können ein größeres (erweitertes) Spektrum an β-Lactam-haltigen Antibiotika spalten. Die ESBL entsteht durch eine Punktmutation der bekannten β-Lactamase. Die Gene für die ESBL befinden sich auf Plasmiden, die von Bakterium zu Bakterium weitergegeben werden können. ESBL tragende Bakterien sind resistent gegen Penicilline, Cephalosporine (Generation 1-4) und gegen Monobactame. Hauptsächlich E. coli und Klebsiellen (Gram-negative Bakterien) tragen ESBL-Gene.
Um trotzdem β-Lactamase-produzierende Bakterien bekämpfen zu können, werden zusätzlich zu einem β-Lactam-Antibiotikum β-Lactamase-Inhibitoren wie Clavulansäure, Sulbactam oder Tazobactam verabreicht. Bei schweren Infektionen sind Mittel der Wahl nur noch Carbapeneme.
Um β-Lactamasen einfach photometrisch nachweisen zu können, wurde das Nitrocefin als Cephalosporin-ähnliche Verbindung entwickelt, denn das Nitrocefin verändert seine Farbe bei der Spaltung durch die β-Lactamasen von gelb zu rot. Die optimale Wellenlänge zur Messung liegt ungefähr bei 486 nm.
Weblinks
Wikimedia Foundation.