- Panton-Valentin-Leukozidin
-
Staphylococcus aureus Systematik Abteilung: Firmicutes Klasse: Bacilli Ordnung: Bacillales Familie: Staphylococcaceae Gattung: Staphylococcus Art: Staphylococcus aureus Wissenschaftlicher Name Staphylococcus aureus Rosenbach 1884 Staphylococcus aureus ist ein kugelförmiges, Gram-positives Bakterium, das häufig in Traubenform angeordnet ist (sog. Haufenkokken). Staphylokokken sind unbeweglich und bilden keine Sporen. Die Größe des Bakteriums liegt üblicherweise zwischen 0,8–1,2 µm. S. aureus kommt fast überall in der Natur und auch bei vielen Menschen auf der Haut und in den oberen Atemwegen vor. Bei 25-30% aller Menschen findet man das Bakterium in der Nase. Meist löst es keine Krankheitssymptome aus. Man spricht in diesem Falle von einer Besiedlung oder Kolonisation der Person mit dem Keim (Kolonisationskeim). Staphylococcus aureus ist also weit verbreitet. Bekommt der Keim durch günstige Bedingungen oder ein schwaches Immunsystem die Gelegenheit, sich auszubreiten, kommt es beim Menschen zu Hautinfektionen (Furunkel, Karbunkel), im Körper zu lebensbedrohlichen Erkrankungen wie Lungenentzündung, Endokarditis, Toxisches Schock-Syndrom (TSS) und Sepsis. Insbesondere Bakterienstämme von S. aureus, die Resistenzen gegen mehrere wichtige Antibiotika erworben haben (sogenannte MRSA-Stämme, siehe auch Multiresistenz), stellen durch schlechte Behandelbarkeit eine Gefahr dar. Bei Tieren ist S. aureus einer der wichtigsten Verursacher von Mastitis.
Inhaltsverzeichnis
Name
Die Bezeichnung Staphylococcus aureus besteht aus einem latinisierten Singular des griechischen σταφυλόκοκκος, wörtlich in etwa „Traubenkugel“, aus älterem Griechisch σταφυλή, staphylé, „Weintraube“ und κόκκος, kókkos, „Kügelchen“ und aureus lateinisch „der goldene“.
Pathomechanismen
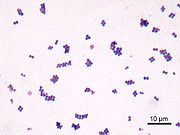 Staphylococcus aureus in der Gramfärbung, man erkennt die charakteristischen namensgebenden traubenförmigen Zusammenballungen.
Staphylococcus aureus in der Gramfärbung, man erkennt die charakteristischen namensgebenden traubenförmigen Zusammenballungen.Staphylococcus aureus besitzt zahlreiche Pathogenitätsfaktoren, darunter eine Polysaccharidkapsel mit Protein A, die das Bakterium vor Aufnahme in Makrophagen (Phagozytose) schützt. Das Protein A bindet Antikörper an deren Fc-Teil, also „verkehrt herum“ - im Gegensatz dazu, wie es für eine Opsonierung sinnvoll wäre. Dadurch kann der Fc-Teil von den Makrophagen nicht mehr erkannt werden und eine Aufnahme und Zerstörung unterbleibt.
Die Koagulase und der Clumping-Faktor A bewirken eine lokale Gerinnung von Fibrin und damit die Ausbildung eines Fibrinwalls, mit dem S. aureus sich umkleidet und von Antikörpern nun nicht mehr erkannt wird. Erst wenn der Keim sich stark vermehrt hat, wird mit Hilfe von Staphylokinase Fibrinolysin gebildet und der Wall aufgebrochen. Mittels der bakteriellen Enzyme Hyaluronidase, DNase, Lipase und dem Hämolysin ist es nun im Stande, interzelluläres Bindegewebe und Parenchymzellen zu lysieren und invasiv in den Wirtsorganismus vorzudringen. Leukocidin hilft dabei, die zellulären Bestandteile der Immunantwort (Granulozyten und Makrophagen) zu schädigen. Auf diesem Wege verursacht S. aureus pyogene (eitrige) Infektionen, die lokal-oberflächlich (beispielsweise Furunkel, Karbunkel) auftreten können, aber auch schwere tiefe, systemische Prozesse (Osteomyelitis, Pneumonie, Endokarditis, Abszesse, Empyeme, Sepsis) mit hoher Letalität bedingen können.
S. aureus kann mehrere Toxine produzieren, die zu verschiedenen typischen Erkrankungen führen:
- Enterotoxine sind Superantigene. Da sie sehr hitzebeständig sind und durch Kochen nicht zerstört werden, spielen sie eine große Rolle bei Lebensmittelvergiftungen (Durchfall, Erbrechen mit kurzer Inkubationszeit von wenigen Stunden).
- Exfoliatine A und B (in etwa 5 % der S. aureus-Isolate vorhanden) sind neben der Invasion der Bakterien beteiligt am Staphylococcal Scalded Skin Syndrome (Morbus Ritter von Rittershain, Pemphigus neonatorum oder Syndrom der verbrühten Haut: Blasenbildung im Bereich der Haut, Rötung, Juckreiz, Lethargie, Fieber oder Hypothermie, Schleimhäute nicht mitbetroffen (im Gegensatz zum Lyell-Syndrom), Blasen ohne Erreger, hauptsächlich bei Kleinkindern und immunsupprimierten Erwachsenen über 60 Jahre, Therapie: symptomatisch: Flüssigkeit, Haut wie bei Brandverletzten (ITS), Clindamycin als Antibiotikum der Wahl)
- Impetigo bullosa: (Blasenbildung nur am Ort der Infektion, bei immunkompetenten Patienten mit Antikörpern gegen Exfoliatine)
- TSS: Toxic Shock Syndrome (klassisch bei Tampon benutzenden Frauen aufgetreten, da Toxin nur im Zustand des Magnesiummangels produziert wird. Heutige Tampons sind sicher. Toxin wirkt als Superantigen und aktiviert viele T-Zellen gleichzeitig: Hautrötung, Fieber, Schock usw.)
- Panton-Valentine-Leukocidin: Nekrotisierende Pneumonien mit hoher Letalität [1].
Staphylococcus aureus zählt zu den wichtigsten Erregern im Krankenhaus erworbener (nosokomialer) Infektionen. Der Erreger ist äußerst widerstandsfähig gegen Einflüsse wie Austrocknung und kann zusätzlich eine Reihe von Resistenzen gegenüber Antibiotika aufweisen.
Multiresistenzen
Gebräuchliche Abkürzungen:
- MRSA = Methicillin-resistenter Staphylococcus aureus
- ORSA = Oxacillin-resistenter Staphylococcus aureus
- VISA = Vancomycin-intermediate Staphylococcus aureus
- VRSA = Vancomycin-resistenter Staphylococcus aureus
Unter nosokomialen (d.h. im Krankenhaus oder anderen Gesundheits- und Pflegeeinrichtungen erworbenen) MRSA (gleichbedeutend auch als ORSA bezeichnet) versteht man Staphylococcus aureus-Stämme, die gegen alle bisher marktverfügbaren Beta-Lactam-Antibiotika (z.B. Penicillin) resistent sind. Sie sind in der Regel auch multiresistent, das heißt sie verfügen auch über Resistenzen gegenüber anderen Antibiotikaklassen. VISA besitzen zusätzlich eine verminderte Empfindlichkeit gegenüber Vancomycin und anderen Glykopeptid-Antibiotika. Die wenigen bisher beschriebenen VRSA-Stämme sind resistent gegenüber Vancomycin und anderen Glykopeptid-Antibiotika.
Methicillin wurde historisch als Testsubstanz für die Antibiotika-Sensitivität von Bakterien eingesetzt. Eine Therapie erfolgt im positiven Fall meist mit Vancomycin, solange natürlich keine Resistenzen gegen dieses Arzneimittel vorliegen. Die Behandlung sollte sich am Antibiogramm orientieren, denn auch gegen Vancomycin sind schon Resistenzen aufgetreten (VRSA).
Methicillin und Oxacillin gehören zu den Penicillinase-stabilen Penicillinen. In Deutschland wird u.a. Oxacillin eingesetzt. Weitere Vertreter dieser Substanzklasse sind Cloxacillin, Dicloxacillin und Nafcillin (in den USA verwendet). Methicillin wird nicht mehr zur Therapie verwendet.
MRSA/ORSA sind häufig auch resistent gegen Antibiotika anderer Gruppen (Chinolone, Tetracycline, Aminoglykoside, Erythromycin, Sulfonamide).
Mechanismus der Resistenz
MRSA besitzen das Resistenzgen mecA, das für ein modifiziertes Penicillin-Bindeprotein (PBP2a, syn. PBB2´) kodiert. Dieses Protein – die bakterielle Transpeptidase – ist normalerweise für die korrekte Verknüpfung der Bausteine der Zellwand verantwortlich. Beta-Lactam-Antibiotika imitieren einen solchen Baustein und führen, wenn sie einmal eingebaut sind dazu, dass keine neuen Verknüpfungen mehr gebildet werden können. (Beta-Lactam-Antibiotika wirken deshalb nur auf wachsende Zellen.)
Das modifizierte Penicillin-Bindeprotein baut jedoch keine Beta-Lactam-Antibiotika in die Zellwand ein und führt dazu, dass MRSA gegen alle Beta-Laktam-Antibiotika (Penicilline, Cephalosporine und Carbapeneme) resistent sind. Charakteristisch für MRSA war bis vor kurzem, dass sie auch gegen weitere Antibiotikaklassen (beispielsweise Tetracycline, Aminoglykoside, Makrolide) Resistenzen erworben haben und damit eine Multiresistenz aufweisen. Seit wenigen Jahren beobachtet man zusätzlich eine neue Gruppe von MRSA, die diese Multiresistenz nicht aufweisen und als sog. community-acquired MRSA (auch community onset MRSA) bezeichnet werden.
Ein weiterer Resistenzmechanismus gegen Beta-Lactame, der aber nicht nur bei den MRSA anzutreffen ist, beruht auf der Bildung eines Enzyms, das Penicillin abbauen kann (Betalactamase).In diesem Zusammenhang ist es bemerkenswert, dass auch Infektionen mit nicht resistenten Staphylococcus-Stämmen, etwa im Mittelohr oder in den Atemwegen, häufig nur sehr schwer mit Antibiotika zu bekämpfen sind. Diese Infektionen neigen dazu chronisch zu werden, das heißt sie flammen immer wieder auf. Lange blieb es ein Rätsel, wie es den Bakterien gelingt, sich so effektiv vor der normalerweise tödlichen Wirkung der Antibiotika zu schützen. Mitte 2007 publizierte jedoch ein Forscherteam das Ergebnis einer Untersuchung[2], nachdem die Bakterien in der Lage sind in Körperzellen einzudringen. Dort fahren die Krankheitserreger ihren Stoffwechsel stark herunter, um in einen Zustand zu verfallen, der an den Winterschlaf mancher Tiere erinnert. Verborgen im Inneren der Körperzellen können sie, unerkannt vom Immunsystem des Wirts und geschützt vor toxischen Antibiotika, Tage bis möglicherweise Wochen ausharren, um sich anschließend erneut auszubreiten.
Entstehung, Vorkommen und Häufigkeit von MRSA
Gegen Antibiotika resistente Stämme dieses Keims kommen vermehrt dort vor, wo ständig Antibiotika verwendet werden, z. B. in Krankenhäusern und Altenheimen. Die Antibiotika töten viele Keime ab. Nur wenige Keime können überleben, weil sie zufällig gegen das angewendete Antibiotikum resistent sind. Diese resistenten Bakterien vermehren sich dann trotz der Antibiotika-Therapie weiter. Dies ist eine klassische Selektion im evolutionsbiologischen Sinn.
Staphylococcus aureus bildet leicht Resistenzen gegen Antibiotika aus. Derart unempfindliche Bakterien können sich auch unter Gabe des Antibiotikums weiter vermehren und sprechen damit nicht mehr auf bestimmte Antibiotika an.MRSA sind weltweit verbreitet. In den USA starben im Jahr 2005 etwa 19.000 Menschen an Infektionen mit MRSA.[3] In Deutschland infizieren sich 40.000 bis 50.000 Patienten jedes Jahr mit MRSA, wobei diese Infektion zwischen 700 und 1.500 Todesopfer fordert. Die Ungenauigkeit liegt darin begründet, dass MRSA in Deutschland – anders als z. B. in Großbritannien – nicht im Totenschein als Diagnose vermerkt wird. Es müsste zudem unterschieden werden, ob eine Infektion oder nur eine Kolonisation mit MRSA vorlag und ob bei Vorliegen einer Infektion diese auch tatsächlich todesursächlich war. Die Prävalenz (Anteil von betroffenen zu nicht betroffenen Personen) von MRSA bei Bewohnern von Altenheimen und Patienten von Reha- und Akutkliniken liegt zwischen 1 bis 4 % [4].
Prozentual beruhen in manchen Kliniken bis zu 30% der im Krankenhaus erworbenen Infektionen auf MRSA. Während in den Niederlanden und den skandinavischen Ländern aufgrund eines guten Krankenhaushygienestandards der Anteil von MRSA unter den S. aureus-Stämmen sehr gering ist (etwa 1%), erreichen MRSA in den südeuropäischen Ländern, in den USA sowie in vielen asiatischen Ländern (Japan) prozentuale Anteile von 30 bis >70%. In Deutschland liegt die MRSA-Rate im Durchschnitt bei etwa 21%, wobei es – je nach Krankenhaushygiene – starke lokale Unterschiede gibt (bis über 50%). Besonders betroffen sind die chirurgischen Intensivstationen, Abteilungen für Brandverletzungen und Neugeborenenstationen.
MRSA sind nicht auf den Menschen beschränkt. In einer Studie wurden 2007 in kanadischen Schweinefarmen MRSA gefunden. Menschen waren in der Hälfte dieser 20 Farmen kolonialisiert, Schweine in einem Viertel. Die genetische Information der Bakterien war jeweils identisch, was eindeutig auf eine Übertragung zwischen Mensch und Tier hinweist.[5] Bereits früher war man in den Niederlanden auf MRSA in der Schweinezucht gestoßen. Es hatte sich gezeigt, dass in Betrieben, in denen Schweine routinemäßig mit Antibiotika behandelt wurden, 60% der Schweine mit MRSA infiziert waren. In Betrieben, in denen die Schweine nicht routinemäßig Antibiotika erhielten, waren nur 5% mit MRSA infiziert. [6]In einer internationalen Studie wurde die Rate kolonialisierter Schweinezucht-Arbeiter mit 12 Prozent bestimmt, wobei Schutzkleidung offensichtlich keinen Nutzen hatte.[7]
MRSA außerhalb des Krankenhauses
MRSA werden zunehmend auch außerhalb des Krankenhauses gefunden. Im englischen Schriftgut werden diese Erreger als Community-acquired methicillin-resistant Staphylococcus aureus (cMRSA oder caMRSA bzw. CA-MRSA) bezeichnet. Darunter gibt es Stämme wie den Pulsed-Field Gelelektrophorese (PFGE)-Typ USA300 (entspricht dem Multi Locus Sequence Typing (MLST)-Typ ST 8) mit besonders aggressivem Verhalten, die das sogenannte Panton-Valentine-Leukocidin aufweisen (PVL-MRSA).
Relevant ist dies auch für den Rettungsdienst bzw. den Krankentransport. Da viele Patienten, die in klinischer Behandlung waren, kolonialisiert sind ohne es zu wissen oder die entsprechenden Symptome zu zeigen, sollte das Rettungsfachpersonal die Anamnese auch auf solche Krankheiten hin betreiben. Der Transport eines MRSA-positiven Patienten erfordert vom Rettungsfachpersonal das Tragen von Schutzkleidung und Einmalhandschuhen sowie eine Schlussdesinfektion des kompletten Fahrzeugs. Hierbei steht nicht der Schutz des Personals im Vordergrund (Eine Kolonialisation mit MRSA bleibt für Gesunde in der Regel folgenlos) sondern eine Eindämmung der Verbreitung von MRSA, da der Rettungs- bzw. Krankentransportdienst durch die hohe Zahl von Patientenkontakten und den häufigen Aufenthalt in Kliniken einen günstigen Vektor darstellt. [8]
Therapie
Zwar kann versucht werden, Infektionen mit MRSA mit so genannten Reserveantibiotika wie Vancomycin und neuerdings Linezolid, Daptomycin, Tigecyclin oder Quinupristin/Dalfopristin zu behandeln. Letztere sind auch gegen vancomycinresistente Staphylococcus aureus wirksam, Linezolid kann auch oral verabreicht werden. Nachdem es im Zusammenhang mit Linezolid-Anwendung zu erhöhter Sterblichkeit kam (weil nicht gegen gram-negative Erreger wirksam, s. Warnhinweise des BfArM[9]), gelten Tigecyclin, Daptomycin neben Vancomycin als Mittel der Wahl. Doch im klinischen Alltag gestaltet sich die Therapie von Patienten mit MRSA-Infektionen oft schwierig und langwierig. Bei manchen Patienten, die bereits auf dem Weg der Besserung sind, ist es möglich, die Antibiotikabehandlung zu beenden. Dann kann sich auch die normale Haut- und Schleimhautflora regenerieren und verdrängt die MRSA-Keime wieder.
Bakteriophagen wurden bis zur Einführung der Antibiotika gegen Infektionen eingesetzt und könnten eine Behandlungsoption gegen multiresistente Keime bieten. Aktuelle Erfahrungen gibt es bislang nur in der ehemaligen Sowjetunion [10] und Polen[11].
Schutzmaßnahmen
Das Auftreten von MRSA-Stämmen im Krankenhaus erfordert gezielte antiepidemische Maßnahmen mit Isolierung des Patienten oder mehrerer mit MRSA besiedelten Patienten in einem Zimmer – sogenannte Kohortenisolierung. Da der Erreger im Krankenhaus meist von Pflegepersonal und Ärzten (iatrogen) verbreitet wird, ist die wichtigste Maßnahme gegen die Ausbreitung multiresistenter Erreger die gründliche Händedesinfektion. In Abhängigkeit von der zu verrichtenden Tätigkeit am Patienten oder der Lokalisation des MRSA beim Patienten werden zusätzlich Einmalhandschuhe, Schutzkittel und Mundschutz getragen. Die strikte Einhaltung der Händehygiene und der Isolierungsmaßnahmen kann die Übertragungsrate in Krankenhäusern deutlich verringern.
Wichtig ist auch die Identifikation und Sanierung von MRSA-Trägern (ohne Krankheitssymptome). Vom Robert-Koch-Institut (RKI) werden Screening-Untersuchungen in Krankenhäusern empfohlen:
- bei Patienten mit u. a. chronischer Pflegebedürftigkeit, liegenden Kathetern, chronischen Wunden
- beim Krankenhauspersonal bei Ausbruch, d. h., bei gehäuftem Nachweis von MRSA bei mehr als zwei Patienten, die in einem räumlichen und zeitlichen Zusammenhang stehen und nachgewiesener klonaler Identität des MRSA.
Ein routinemäßiges Screening von Patienten und Personal birgt laut RKI einen zu hohen Aufwand und wird deshalb nicht empfohlen. Diese Frage gilt jedoch als umstritten, da beispielsweise in den Niederlanden durch konsequentes Screening eine deutliche Reduzierung der MRSA-Prävalenz erreicht werden konnte. Im Rahmen des EUREGIO-Projektes MRSA-net wird diese Thematik daher seit 2005 länderübergreifend untersucht.
Neuentstehung und Ausbreitung von MRSA können nur eingedämmt werden durch rationellen und erregerorientierten Einsatz von Antibiotika, Nichtverwenden von Antibiotika, falls diese nicht erforderlich sind (leichtere Virusinfektionen der Atemwege ohne größere Gefahr der Zweitinfektion mit Bakterien), konsequentes Umsetzen der Hygienemaßnahmen im Krankenhaus und gegebenenfalls Isolierung und Sanierung betroffener Patienten.
Versorgung und Kennzeichnung von Verstorbenen mit MRSA
Wenn Patienten in der Klinik oder einer anderen Einrichtung verstorben sind, die Träger von MRSA waren, so sind diese aus gesetzlicher Sicht (dt. Bestattungsgesetz) keine Leichen nach Infektionskrankheiten. Die Besiedelung ist nach dem Infektionsschutzgesetz nicht meldepflichtig. Beim Umgang mit Leichen sind die üblicherweise erforderlichen Hygienemaßnahmen ausreichend. Der Leichenschau durchführende Arzt wird deshalb auf der Todesbescheinigung in solchen Fällen unter Infektionsgefahr NEIN ankreuzen.
Phytotherapie
Extrakte verschiedener Pflanzenarten zeigen im Labor teilweise hohe Aktivität gegen MRSA mit mehreren Resistenzen, die in manchen Fällen synergistisch mit Penicillinen ist: hohe Aktivität zeigte Indisches Basilikum (Ocimum tenuiflorum), weiterhin Darjeeling-Tee (Camellia sinensis), der Flammenbaum (Delonix regia), Holarrhena antidysenterica, der Hennastrauch (Lawsonia inermis), Granatapfel (Punica granatum), Terminalia chebula und Terminalia belerica (zwei Flügelsamengewächse).
Andererseits waren Knoblauch (Allium sativum) und Orange (Citrus sinensis) wenig aktiv. In allen genannten Pflanzenextrakten konnten Phenole und Flavonoide als Träger der Aktivität festgestellt werden[12]. In einer anderen Laborstudie waren neben dem genannten indischen Basilikum auch Sesam- und Sojabohnenöl moderat wirksam[13] [14].
In der klinischen Routine werden diese Substanzen angesichts noch nicht ausreichender Wirksamkeitsnachweise nicht eingesetzt.
Quellen
- ↑ M. Labandeira-Rey, F. Couzon, S. Boisset, E. L. Brown, M. Bes, Y. Benito, E. M. Barbu, V. Vazquez, M. Hook, J. Etienne: Staphylococcus aureus Panton-Valentine Leukocidin Causes Necrotizing Pneumonia. In: Science. 315, Nr. 5815, 2007, S. 1130–1133 (doi:10.1126/science.1137165).
- ↑ Warum Staphylococcus aureus so hartnäckig ist - Wissenschaft.de über eine Online-Vorabveröffentlichung von C. Garzoni et al., In: BMC Genomics
- ↑ Klevens et al.: Invasive Methicillin-Resistant Staphylococcus aureus Infections in the United States. JAMA 298/15/2007. S. 1763. Online-PDF
- ↑ Woltering, R.; Hoffmann, G.; Daniels-Haardt, I.; Gastmeier, P.; Chaberny, I. F.: MRSA-Prävalenz in medizinischen und pflegerischen Einrichtungen eines Landkreises. Dtsch Med Wochenschr. 2008;133(19):999-1003
- ↑ T. Khanna et al.: Methicillin resistant Staphylococcus aureus colonization in pigs and pig farmers. Vet. Microbiol. In Press, Accepted Manuscript, Available online 16 October 2007 doi:10.1016/j.vetmic.2007.10.006
- ↑ Michael Pollan The Way We Live Now - Our Decrepit Food Factories. The New York Times, Available online 23 Februar 2009 2007 [1]
- ↑ M. W. Wulf et al.: Prevalence of methicillin-resistant Staphylococcus aureus among veterinarians: an international study. Clin Microbiol Infect. 6 Nov 2007 doi:10.1111/j.1469-0691.2007.01873.x
- ↑ Siehe dazu: Dtsch Med Wochenschr. 2005 Mar 18;130(11):582-5; quiz 589-92. Infektionen mit Methicillin-resistentem Staphylococcus aureus: Bedeutung des Pathogenitätsfaktors Panton-Valentine Leukozidin
- ↑ Linezolid (Zyvoxid®): Erhöhte Mortalität bei schweren Haut- und Weichteilinfektionen, die nicht ausschließlich durch grampositive Erreger verursacht werden – Anwendungsbeschränkungen beschlossen. In: Pharmakovigilanz/Risikoinformationen. Bundesinstitut für Arzneimittel und Medizinprodukte, 16.03.2007. Abgerufen am 09.06.2008.
- ↑ Kropinski AM: Phage therapy – everything old is new again. Can J Infect Dis Med Microbiol 2006 (17):297–306.
- ↑ Miedzybrodzki R, et al.: Phage therapy of staphylococcal infections (including MRSA) may be less expensive than antibiotic treatment. Postepy Hig Med Dosw (Online) 2007 (61):461-5. PMID: 17679835
- ↑ F. Aqil et al.: Effect of certain bioactive plant extracts on clinical isolates of beta-lactamase producing methicillin resistant Staphylococcus aureus. J Basic Microbiol. 45/2/2005. S. 106-14. PMID 15812867
- ↑ S. Singh et al.: Antibacterial activity of Ocimum sanctum L. fixed oil. Indian J Exp Biol. 43/9/2005. S. 835-7. PMID 16187537
- ↑ Ethnoline Peru: Impacto de la combinacion de Croton Lechleri, Piper Angostifolium y Plantago Major en la curacion de Estafiloco Aureus en las vias respiratorias superiores - Klaus Hönninger - Lima 2006
Literatur
- Empfehlung zur Prävention und Kontrolle von Methicillin-resistenten Staphylococcus aureus-Stämmen (MRSA) in Krankenhäusern und anderen medizinischen Einrichtungen. Mitteilung der Kommission für Krankenhaushygiene und Infektionsprävention am RKI, Bundesgesundheitsblatt 1999, 42 (12) S. 954-958 Seite des RKI mit Informationen zu MRSA, dieser ist als PDF von dort downloadbar
- Kipp, Frank; Friedrich, Alexander W.; Becker, Karsten; von Eiff, Christof. Bedrohliche Zunahme Methicillin-resistenter Staphylococcus-aureus-Stämme: Strategien zur Kontrolle und Prävention in Deutschland Dtsch Arztebl 2004; 101(28-29): A-2045 [2]
Weblinks
- Staphylokokken und MRSA – Informationen des Robert Koch-Instituts
- Infoseite der Uni Köln zu MRSA
- Der wichtigste Erreger im Zusammenhang mit der chronischen/rezidivierenden Furunkulose
- MRSA: Neuer Problemkeim www.sueddeutsche.de, vom 17. Januar 2008
- SARI Antibiotika-Anwendung und Resistenzentwicklung auf deutschen Intensivstationen
- New Strategy Cracks Staph Bacterium's "Golden Armor," Making It Vulnerable To Treatment
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.



