- Bethe-Weizsäcker-Massenformel
-
Die Bethe-Weizsäcker-Formel ist eine Formel zur Beschreibung der Bindungsenergie von Atomkernen nach dem Tröpfchenmodell. Der Begriff Bindungsenergie kann als Synonym zum Begriff potentielle Energie in der klassischen Physik betrachtet werden. Im sogenannten Tröpfchenmodell werden die Nukleonen wie Moleküle eines inkompressiblen geladenen Flüssigkeitströpfchens betrachtet.
Die halbempirische Formel wurde erstmals 1935 von Carl Friedrich von Weizsäcker aufgestellt.
Inhaltsverzeichnis
Formel
Für einen Kern mit N Neutronen und Z Protonen und damit einer Nukleonenzahl A = N + Z ergibt sich die Bindungsenergie EB aus den unten aufgeführten fünf Summanden. Dies gilt nur für Kerne mit einer Nukleonenzahl größer 30. Kleinere Kerne weisen Unregelmäßigkeiten auf, die nicht in der Bethe-Weizsäcker-Formel berücksichtigt sind.
Streng genommen müsste man auch die Bindungsenergie der Elektronen an den Atomkern beachten. Die Atommasse ist wegen der Bindungsenergie der Elektronen an den Kern stets etwas kleiner als die Summe aus der Kernmasse und den Massen der Z Elektronen. Typische Elektronenbindungsenergien liegen im Bereich von einigen keV. Im Vergleich zu den Kernbindungsenergien, die im Bereich mehrerer MeV liegen, kann die Elektronenbindungsenergie daher im Rahmen der möglichen Genauigkeit der hier behandelten Formel vernachlässigt werden.
Über die Bindungsenergie lässt sich die gesamte Kernmasse m berechnen:
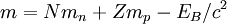 mit der Ruhemasse des Neutrons mn = 939,553 MeV/c² und der Ruhemasse des Protons
mit der Ruhemasse des Neutrons mn = 939,553 MeV/c² und der Ruhemasse des Protons 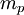 = 938,259 MeV/c². Mit dieser Erweiterung wird die Formel auch häufig Massenformel genannt. Die für den Kern erhaltene Masse lässt sich über die Beziehung
= 938,259 MeV/c². Mit dieser Erweiterung wird die Formel auch häufig Massenformel genannt. Die für den Kern erhaltene Masse lässt sich über die Beziehung 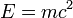 auch durch eine Energie ausdrücken.
auch durch eine Energie ausdrücken.Die gesamte Bindungsenergie eines Atomkerns setzt sich aus fünf Beiträgen zusammen:
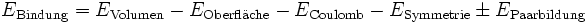
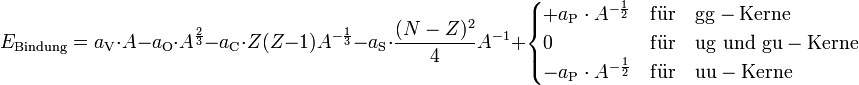
Die Addition der Anteile ergibt die Bindungsenergie. Die Formel ist unbrauchbar für sehr leichte Atomkerne mit geringer Nukleonenzahl, für größere Kerne ist sie eine gute Näherung. Aber auch hier kann sie beispielsweise die Magischen Zahlen nicht erklären, erst das Schalenmodell liefert hierfür eine Erklärung.
Erläuterung der fünf Beiträge
Volumenanteil
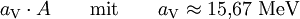
Die Volumenenergie resultiert aus der gegenseitigen Anziehung der Nukleonen aufgrund der starken Kernkraft. Da diese aber äußerst kurzreichweitig ist, trägt immer nur die Wechselwirkung mit den nächsten Nachbarn eines Nukleons zur Bindung bei. Für ein von allen Seiten mit anderen Nukleonen umgebenes Nukleon, wie es in großen Kernen der Fall ist, ist somit die Bindungsenergie unabhängig von der Gesamtzahl der Nukleonen.
Oberflächenanteil

Die Nukleonen an der Oberfläche sind von weniger Nachbarn umgeben als die Nukleonen im Inneren des Kerns. Dadurch sind sie schwächer gebunden und reduzieren die Bindungsenergie. Der Oberflächenterm beschreibt das Verhältnis von Oberfläche und Volumen. Die Oberfläche einer Kugel ist proportional zu R2 und daher auch zu
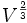 . Wegen V = A (siehe Volumenanteil) gilt
. Wegen V = A (siehe Volumenanteil) gilt 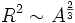 . V.a. bei kleinen Kernen mit wenigen Nukleonen macht sich der Oberflächenanteil stark bemerkbar. Er wird mit wachsender Nukleonenzahl immer kleiner.
. V.a. bei kleinen Kernen mit wenigen Nukleonen macht sich der Oberflächenanteil stark bemerkbar. Er wird mit wachsender Nukleonenzahl immer kleiner.Coulomb-Anteil
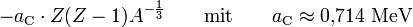
Je größer ein Kern wird, desto größer wird die gegenseitige Coulomb-Abstoßung der Protonen im Kern. Da die Coulomb-Energie einer homogen geladenen Kugel proportional zu
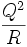 ist, ergibt sich daraus unter Berücksichtigung der oben genannten Proportionalitäten durch Einsetzen der Kernladung Z für die Ladung Q:
ist, ergibt sich daraus unter Berücksichtigung der oben genannten Proportionalitäten durch Einsetzen der Kernladung Z für die Ladung Q: 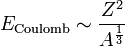 . Dies ist auch der Grund dafür, dass Atome nur bis zu einer Ordnungszahl von 82 dauerhaft bestehen können. Durch diese Abstoßung wird die Bindungsenergie ebenfalls verringert.
. Dies ist auch der Grund dafür, dass Atome nur bis zu einer Ordnungszahl von 82 dauerhaft bestehen können. Durch diese Abstoßung wird die Bindungsenergie ebenfalls verringert.Symmetrieanteil

Dieser Term ist quantenmechanischer Natur und sorgt für ein Gleichgewicht zwischen Neutronenzahl und Protonenzahl. Er verschwindet für N = Z und schwächt die Bindung mit zunehmender Differenz zwischen Neutronen- und Protonenzahl. Da sowohl Neutronen als auch Protonen der Fermistatistik folgen, gilt das Pauliprinzip, wonach jeder Quantenzustand nur einfach besetzt werden kann. Der energetisch höchst besetzte Zustand definiert die Fermienergie. Die Symmetrieenergie sorgt dafür, dass Neutronen und Protonen dieselbe Fermienergie haben.
Teilweise findet man in der Literatur einen Wert
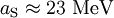 . Dort wurde die 4 aus dem Nenner mit in die Konstante eingerechnet und taucht in der Formel nicht mehr auf.
. Dort wurde die 4 aus dem Nenner mit in die Konstante eingerechnet und taucht in der Formel nicht mehr auf.Paarungsanteil

gg-Kerne sind somit besonders stabil. Dies kann als Bindung von je zwei Protonen oder zwei Neutronen zu einem Paar gesehen werden, wodurch die Bindungsenergie erhöht wird; bei ungerader Protonen- und/oder Neutronenzahl bleibt jeweils ein ungepaartes Teilchen übrig, das deshalb lockerer gebunden ist.
Die angegebenen Werte für die empirischen Parameter werden aus experimentell gemessenen Kernmassen bestimmt, indem die Massenformel an die Bindungsenergien von mindestens fünf Kernen angepasst wird. Je nach Wahl dieser Kerne variieren die genauen Werte in der Literatur. Dies liegt dann daran, dass die Formeln für jeweils andere Massenbereiche optimiert wurden.
Eine Erläuterung zu den einzelnen Termen befindet sich ebenfalls im Artikel Tröpfchenmodell.
Siehe auch: Hans Bethe, Carl Friedrich von Weizsäcker
Literatur
- Weizsäcker, C. F. von: Zur Theorie der Kernmassen; in: Zeitschrift für Physik 96 (1935) 431-458
Wikimedia Foundation.