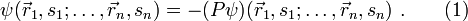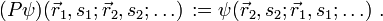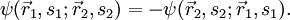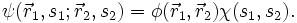- Pauliprinzip
-
Das Pauli-Prinzip (auch paulisches Ausschlussprinzip) ist ein wichtiges, experimentell entdecktes Prinzip der Quantenmechanik und hängt mit dem Spin zusammen. Es ist nach seinem Entdecker Wolfgang Pauli benannt. Es besagt, dass bei Vertauschung von Fermionen die Wellenfunktion antisymmetrisch ist. Daraus ergibt sich insbesondere, dass Elektronen (oder andere Fermionen), die den gleichen Raum belegen, nicht in allen Quantenzahlen übereinstimmen dürfen. Das Pauli-Prinzip bestimmt entscheidend den atomaren Aufbau; eine Folge davon ist u.a., dass normale Materie nicht beliebig kondensierbar ist.
Inhaltsverzeichnis
Spezielle Form (Pauli-Verbot)
In seiner zuerst beobachteten und einfachsten Form gilt, dass in einem Atom keine zwei Elektronen in allen vier Quantenzahlen, die zu seiner Zustandsbeschreibung im Atommodell notwendig sind, übereinstimmen dürfen. Dadurch ergibt sich der Aufbau des Periodensystems der Elemente. Die vier relevanten Quantenzahlen im Atom sind dabei die Haupt-, Neben- und die Spinquantenzahl, sowie die Magnetische Quantenzahl, wobei die Hauptquantenzahl im Schalenmodell der Schale entspricht, auf der sich ein Elektron befindet.
Aufgrund des Pauli-Prinzips kann in der Orbital-Theorie ein Orbital nur jeweils zwei Elektronen aufnehmen. Die beiden Elektronen müssen sich in der Spinquantenzahl, welche nur die Werte
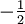 und
und 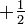 annehmen kann, unterscheiden.
annehmen kann, unterscheiden.Allgemeine Form (verallgemeinertes Pauli-Prinzip)
Formulierung
Die Gesamtwellenfunktion
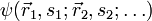 eines Systems von n Fermionen muss total antisymmetrisch bezüglich der Vertauschung P zweier Teilchen sein:
eines Systems von n Fermionen muss total antisymmetrisch bezüglich der Vertauschung P zweier Teilchen sein:Dabei sind
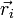 der Ort, si der Spin des i-ten Fermions und P der Permutationsoperator, der die Vertauschung jeweils zweier Teilchen bewirkt, also z. B.
der Ort, si der Spin des i-ten Fermions und P der Permutationsoperator, der die Vertauschung jeweils zweier Teilchen bewirkt, also z. B.Ableitung
Sind zwei Teilchen ununterscheidbar, muss das Betragsquadrat der Wellenfunktion gegenüber der Vertauschung invariant sein:
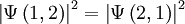 .
.
Somit beschränkt sich die Wirkung des Permutationsoperators auf die Änderung des komplexen Anteils der Wellenfunktion und die Vertauschung der Teilchen:
 .
.
Weitere Anwendung des Permutationsoperators macht die Vertauschung rückgängig:
 .
.
Um das Betragsquadrat konstant zu halten muss also gelten:
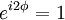 und
und 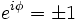 .
.
Somit kann man zwischen zwei Sorten Teilchen unterscheiden, solchen bei denen sich unter Permutation das Vorzeichen der Wellenfunktion ändert (Fermionen), und solchen, bei denen sich das Vorzeichen der Wellenfunktion unter Permutation nicht ändert (Bosonen).
Anschauliche Deutung
Betrachtet man ein System aus zwei nichtunterscheidbaren Fermionen, so gilt wegen der Antisymmetrie der Gesamtwellenfunktion
Für
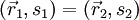 ergibt sich daraus
ergibt sich daraus 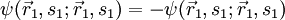 , d.h.
, d.h. 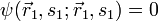 . Die Wahrscheinlichkeit(sdichte) dafür, dass man bei einer Messung beide Fermionen am selben Ort
. Die Wahrscheinlichkeit(sdichte) dafür, dass man bei einer Messung beide Fermionen am selben Ort 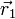 mit selbem Spin
mit selbem Spin 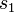 findet, ist also Null.
findet, ist also Null.In vielen Fällen (ein solcher Fall ist z.B. für nichtentartete Eigenfunktionen von Hamilton-Operatoren ohne Spin-Bahn-Kopplung stets gegeben) ist die Gesamtwellenfunktion
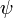 als Produkt von Ortswellenfunktion
als Produkt von Ortswellenfunktion 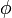 und Spinwellenfunktion
und Spinwellenfunktion 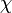 darstellbar, also
darstellbar, alsoWegen der Antisymmetrie ist dann
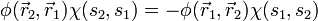 . Ist etwa die Spinwellenfunktion symmetrisch, also
. Ist etwa die Spinwellenfunktion symmetrisch, also 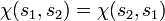 , so folgt daraus die Antisymmetrie der Ortswellenfunktion
, so folgt daraus die Antisymmetrie der Ortswellenfunktion 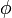 . Entsprechend gilt allgemein, dass die Symmetrie einer der Funktionen
. Entsprechend gilt allgemein, dass die Symmetrie einer der Funktionen 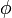 oder
oder 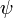 äquivalent zur Antisymmetrie der jeweils anderen ist. Sind also die zwei Fermionen etwa im selben Spinzustand
äquivalent zur Antisymmetrie der jeweils anderen ist. Sind also die zwei Fermionen etwa im selben Spinzustand  , dann ist
, dann ist 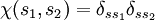 symmetrisch und daher folgt die Antisymmetrie der Ortswellenfunktion.
symmetrisch und daher folgt die Antisymmetrie der Ortswellenfunktion.Diese Zusammenhänge gelten sinngemäß auch dann, wenn mehr als zwei nichtunterscheidbare Fermionen beteiligt sind.
Gültigkeit
Das Pauli-Prinzip gilt für alle Fermionen (Teilchen mit halbzahligem Spin). Diese genügen der Fermi-Dirac-Statistik aufgrund des sogenannten Spin-Statistik-Theorems.
Neben Fermionen gibt es auch Teilchen mit ganzzahligem Spin. Für diese so genannten Bosonen gilt das Pauli-Prinzip nicht. Präziser gesagt: es gilt mit der Änderung, dass in Gleichung (1) der Ausdruck − (Pψ...) durch + (Pψ...) zu ersetzen ist. Diese Teilchen genügen damit der Bose-Einstein-Statistik und können gleiche Quantenzustände einnehmen (im Extremfall bis zum Bose-Einstein-Kondensat).
Kurz zusammengefasst: Die Gesamtwellenfunktion ψ muss für Fermionen antisymmetrisch und für Bosonen symmetrisch sein.
Nur bei zweidimensionaler Geometrie sind auch Teilchen mit beliebiger Phase, sog. Anyonen, möglich.
Permutations- und Drehverhalten
Das unterschiedliche Permutationsverhalten von Fermionen und Bosonen passt genau zum unterschiedlichen Drehverhalten der jeweiligen Spinoren. In beiden Fällen ergibt sich ein Faktor von
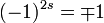 , mit dem (+)-Zeichen für Bosonen (s ganzzahlig) und dem (-)-Zeichen für Fermionen (s halbzahlig), entsprechend einer Drehung um 360o. Der Zusammenhang ist u. a. deshalb naheliegend, weil eine Vertauschung der Teilchen 1 und 2 in der Tat einer komplementären Drehung der beiden Teilchen um 1800 entspricht (z. B. Teilchen 1 zum Ort 2 auf dem oberen Halbkreis, Teilchen 2 zum Ort 1 auf dem unteren Halbkreis).
, mit dem (+)-Zeichen für Bosonen (s ganzzahlig) und dem (-)-Zeichen für Fermionen (s halbzahlig), entsprechend einer Drehung um 360o. Der Zusammenhang ist u. a. deshalb naheliegend, weil eine Vertauschung der Teilchen 1 und 2 in der Tat einer komplementären Drehung der beiden Teilchen um 1800 entspricht (z. B. Teilchen 1 zum Ort 2 auf dem oberen Halbkreis, Teilchen 2 zum Ort 1 auf dem unteren Halbkreis).Konsequenzen
Das Pauli-Prinzip führt zur Austauschwechselwirkung und ist für die Spinordnung in Atomen (Hundsche Regeln) und Festkörpern (Magnetismus) verantwortlich.
In der Astrophysik wird durch das Pauli-Prinzip erklärt, dass alte Sterne mit Ausnahme der sog. Schwarzen Löcher – zum Beispiel Weiße Zwerge oder Neutronensterne – nicht unter ihrer eigenen Gravitation zusammenbrechen. Hierbei erzeugen die Fermionen einen Gegendruck, der einer weiteren Kontraktion entgegenwirkt.
Siehe auch
Wikimedia Foundation.