- 1-Deoxygalactonojirimycin
-
Strukturformel 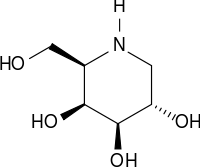
Allgemeines Name 1-Deoxygalactonojirimycin Andere Namen - 1-Deoxygalactonojirimycin
- 1-Deoxygalactostatin
- 1,5-Dideoxy-1,5-imino-D-galactitol
- DGJ
- AT1001 (Entwicklungscode)
- (2R,3S,4R,5S)-2-(Hydroxymethyl)piperidin-3,4,5-triol (IUPAC)
Summenformel C6H13NO4 CAS-Nummer 108147-54-2 (freie Base)
75172-81-5 (Hydrochlorid)PubChem 176077 Kurzbeschreibung weißer kristalliner Feststoff
Eigenschaften Molare Masse 163,17 g·mol−1 (freie Base) Aggregatzustand fest
Löslichkeit als Hydrochlorid leicht löslich in Wasser
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] Hydrochlorid

Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36-37-38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1-Deoxygalactonojirimycin (DGJ), internationaler Freiname Migalastat, ist ein reversibler kompetitiver Inhibitor der Enzymklasse der Galactosidasen. Migalastat ist ein experimenteller Arzneistoff zur Behandlung der lysosomalen Speicherkrankheit Morbus Fabry. Es ist ein pharmakologisches Chaperon.
Inhaltsverzeichnis
Beschreibung
Chemisch gesehen ist der Iminozucker 1-Deoxygalactonojirimycin ein Analogon der Galactose. Die Ähnlichkeit zu der endständigen Galactose-Gruppe des Moleküls Globotriaosylceramid (Gb3) gibt der Verbindung ihr pharmakologisches Potenzial zur möglichen Behandlung des Morbus Fabry. Migalastat befindet sich derzeit (Stand Oktober 2011) in der klinischen Phase III zur Behandlung von Morbus Fabry.[3]
Wirkstoffpotenzial
Migalastat soll als pharmakologisches Chaperon die korrekte Faltung von Mutationsvarianten des Enzyms α-Galactosidase A ermöglichen. Morbus-Fabry-Patienten produzieren in ihren Zellen aufgrund einer Genmutation Varianten der α-Galactosidase A, die wegen ihrer falschen Faltung von der Proteinqualitätskontrolle im endoplasmatischen Retikulum (ER) ausgesondert und dem Proteasom zum Abbau zugeführt werden. In vielen Fällen könnten diese mutierten Enzymvarianten nicht nur die Proteinqualitätskontrolle bestehen, sondern auch ihrer Funktion als Enzym im Lysosom nachkommen, wenn sie korrekt gefaltet wären. Migalastat soll in diesen Prozess eingreifen, indem es als Faltungs-Templat der α-Galactosidase A dient. Dadurch soll die Faltungsdynamik des Proteins in Richtung der richtigen Konformation verschoben und stabilisiert werden. Mit der korrekten Tertiärstruktur wird die Qualitätskontrolle im ER „bestanden“.[4][5] Der stabile Chaperon-α-Galactosidase-A-Komplex wird durch Vesikel des endoplasmatischen Retikulums in den Golgi-Apparat und dann in das Lysosom transferiert. Dort soll Migalastat durch das natürliche Substrat (Gb3) ersetzt werden.[6] Die Dissoziation des Komplexes soll dabei durch die hohe Konzentration an Gb3 und den niedrigen pH-Wert im Lysosom begünstigt werden.[7]
Die EC50-Werte für α-Galactosidase A sind stark abhängig von der vorliegenden Mutationsvariante. Bei der in-vitro-Untersuchung von Lymphozyten mit 49 unterschiedlichen Missense-Mutationen variierten die EC50-Werte zwischen 820 nmol/L bis über >1 mmol/L.[8]
Natürliches Vorkommen
Bisher wurde 1-Deoxygalactonojirimycin nicht in der Natur gefunden. Ein Derivat von DGJ, β-1-C-Butyl-DGJ, wurde im Jahr 2000 aus der Gattung Adenophora sp. – einer Glockenblume – isoliert.[9] 1988 wurde 1-Deoxygalactonojirimycin erstmals aus der Fermentationsbrühe von Streptomyces lydicus PA-5726 gewonnen.[10][11]
Synthese
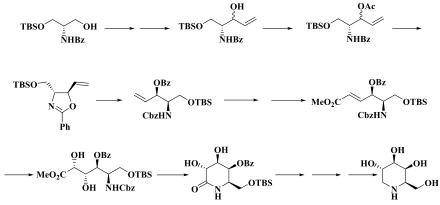
Die Totalsynthese von 1-Deoxygalactonojirimycin ist, für solch ein kleines Molekül, relativ aufwändig. Ein Syntheseweg geht D-N-Benzoylserinol, einem Derivat des Serinols (=2-Amino-1,3-propandiol), aus und führt über mehrere Stufen zu einem trans-Oxazolin (Bildmitte, links), aus dem in etwa 25%iger Ausbeute das 1-Deoxygalactonojirimycin nach acht weiteren Stufen erhalten werden kann.[12] In der Literatur sind weitere Synthesewege beschrieben.[13] Eine elegante Synthese geht über insgesamt acht Stufen und hat eine Gesamtausbeute von 35 bzw 43 %[14] bei über 99 % Enantiomerenreinheit.[15]
Weiterführende Literatur
- P. Compain, O. R. Martin (Hrsg.): Iminosugars: from synthesis to therapeutic applications. Verlag John Wiley and Sons, 2007, ISBN 0-470-03391-6 Eingeschränkte Vorschau in der Google Buchsuche
- K. Suzuki, T. Nakahara, O. Kanie: 3,4-Dihydroxypyrrolidine as glycosidase inhibitor. In: Current topics in medicinal chemistry. Band 9, Nummer 1, 2009, S. 34–57, ISSN 1873-4294. PMID 19199995. (Review).
- R. Khanna, R. Soska u.a.: The pharmacological chaperone 1-deoxygalactonojirimycin reduces tissue globotriaosylceramide levels in a mouse model of Fabry disease. In: Molecular therapy : the journal of the American Society of Gene Therapy. Band 18, Nummer 1, Januar 2010, S. 23–33, ISSN 1525-0024. doi:10.1038/mt.2009.220. PMID 19773742. PMC 2839206.
- E. R. Benjamin, J. J. Flanagan u.a.: The pharmacological chaperone 1-deoxygalactonojirimycin increases alpha-galactosidase A levels in Fabry patient cell lines. In: Journal of inherited metabolic disease. Band 32, Nummer 3, Juni 2009, S. 424–440, ISSN 1573-2665. doi:10.1007/s10545-009-1077-0. PMID 19387866.
- S. Reißmann: Synthese und Glycosidase-Inhibitoreigenschaften von Calysteginen. Dissertation, Universität Halle-Wittenberg, 2006
Einzelnachweise
- ↑ Datenblatt Deoxygalactonojirimycin hydrochloride , bei Sigma-Aldrich, abgerufen am 7. Oktober 2011.
- ↑ a b 259544 Deoxygalactonojirimycin, Hydrochloride. Calbiochem vom 28. September 2010, MSDS (PDF) vom 28. September 2010
- ↑ Klinische Studie (Phase III): Study of the Effects of Oral AT1001 (Migalastat Hydrochloride) in Patients With Fabry Disease bei Clinicaltrials.gov der NIH
- ↑ S. Ishii, H. H. Chang u.a.: Preclinical efficacy and safety of 1-deoxygalactonojirimycin in mice for Fabry disease. In: The Journal of pharmacology and experimental therapeutics. Band 328, Nummer 3, März 2009, S. 723–731, ISSN 1521-0103. doi:10.1124/jpet.108.149054. PMID 19106170.
- ↑ R. Hamanaka, T. Shinohara u.a.: Rescue of mutant alpha-galactosidase A in the endoplasmic reticulum by 1-deoxygalactonojirimycin leads to trafficking to lysosomes. In: Biochimica et biophysica acta. Band 1782, Nummer 6, Juni 2008, S. 408–413, ISSN 0006-3002. doi:10.1016/j.bbadis.2008.03.001. PMID 18381081.
- ↑ S. Biastoff, B. Dräger: Calystegines. In: G. A. Cordell (Hrsg.): The Alkaloids: Chemistry and Biology. S. 91. Eingeschränkte Vorschau in der Google Buchsuche
- ↑ G. H. Yam, N. Bosshard u.a.: Pharmacological chaperone corrects lysosomal storage in Fabry disease caused by trafficking-incompetent variants. In: American journal of physiology. Band 290, Nummer 4, April 2006, S. C1076–C1082, ISSN 0363-6143. doi:10.1152/ajpcell.00426.2005. PMID 16531566.
- ↑ E. R. Benjamin, J. J. Flanagan u.a.: The pharmacological chaperone 1-deoxygalactonojirimycin increases alpha-galactosidase A levels in Fabry patient cell lines. In: Journal of inherited metabolic disease. Band 32, Nummer 3, Juni 2009, S. 424–440, ISSN 1573-2665. doi:10.1007/s10545-009-1077-0. PMID 19387866.
- ↑ K. Ikeda, M. Takahashi u.a.: Homonojirimycin analogues and their glucosides from Lobelia sessilifolia and Adenophora spp. (Campanulaceae). In: Carbohydrate research. Band 323, Nummer 1–4, Januar 2000, S. 73–80, ISSN 0008-6215. PMID 10782288.
- ↑ Y. Miyake, M. Ebata: The structures of a β-galactosidase inhibitor, Galactostatin, and its derivatives. In: Agric Biol Chem. Band 52, 1988, S. 661–666.
- ↑ N. Asano: Naturally occuring iminosugars and related alkaloids: structure, activity and applications. In: P. Compain, O. R. Martin (Hrsg.): Iminosugars: from synthesis to therapeutic applications. Verlag John Wiley and Sons, 2007, ISBN 0-470-03391-6, S. 17. Eingeschränkte Vorschau in der Google Buchsuche
- ↑ S. J. Pyun, K. Y. Lee u.a.: Synthesis Of (+)-1-Deoxygalactonojirimycin. In: Heterocycles. Band 62, 2004, S. 333-341.
- ↑ A. B. Hughes, A. J. Rudge: Deoxynojirimycin: synthesis and biological activity. In: Natural product reports. Band 11, Nummer 2, April 1994, S. 135–162, ISSN 0265-0568. PMID 15209127. (Review).
- ↑ O. K. Karjalainen, A. M. P. Koskinen: Rapid and practical synthesis of (−)-1-deoxyaltronojirimycin. In: Org Biomol Chem. Band 9, 2011, S. 1231-1236. doi:10.1039/C0OB00747A
- ↑ O. K. Karjalainen, M. Passiniemi, A. M. Koskinen: Short and straightforward synthesis of (-)-1-deoxygalactonojirimycin. In: Organic letters. Band 12, Nummer 6, März 2010, S. 1145–1147, ISSN 1523-7052. doi:10.1021/ol100037c. PMID 20170191.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Reizender Stoff
- Enzyminhibitor
- Arzneistoff
- Iminozucker
- Piperidin
Wikimedia Foundation.