- Amifampridin
-
Strukturformel 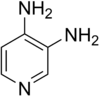
Allgemeines Freiname Amifampridin Andere Namen - Pyridin-3,4-diamin (IUPAC)
- 3,4-Diaminopyridin
- 3,4-DAP
Summenformel C5H7N3 CAS-Nummer 54-96-6 PubChem 5918 ATC-Code N07XX05
Kurzbeschreibung hellbraune Kristalle[1]
Arzneistoffangaben Wirkmechanismus Kaliumkanal-Blocker
Verschreibungspflichtig: ja Eigenschaften Molare Masse 109,13 g·mol−1 Schmelzpunkt Löslichkeit wasserlöslich[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [1] 
Gefahr
H- und P-Sätze H: 300-311-315-319-330-335 EUH: keine EUH-Sätze P: 260-264-280-284-305+351+338-310 [1] EU-Gefahrstoffkennzeichnung [1]
T+
Sehr giftigR- und S-Sätze R: 25-26-36/37/38 S: 26-28-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Amifampridin ist ein Arzneistoff aus der Gruppe der reversiblen Kaliumkanal-Blocker, der u. a. zur Behandlung der Muskelschwäche beim myasthenischen Lambert-Eaton-Syndroms (LEMS) eingesetzt wird. Chemisch ist der Stoff den Aminopyridinen zuzuordnen.
Inhaltsverzeichnis
Klinische Angaben
Zugelassenes Anwendungsgebiet (Indikation)
Amifampridin ist in der Europäischen Union (EU) zur symptomatischen Behandlung des myasthenischen Lambert-Eaton-Syndroms (LEMS) bei Erwachsenen zugelassen. In der Schweiz besteht keine Zulassung für Amifampridin.
Weitere mögliche Anwendungsgebiete
Bei der 2008 erfolgten Unterstellung unter die Verschreibungspflicht in Deutschland werden u. a. die folgenden möglichen Anwendungsgebiete genannt:
- präsynaptisch bedingte angeborene Myasthenie-Syndrome
- Multiple Sklerose
- Rückenmarksschädigungen
- Störungen der Augenbewegungen
- Vergiftungen mit Calciumantagonisten
- Botulismus.
Eine Wirksamkeit für diese Anwendungsgebiete lässt sich aus der Literatur nicht oder nur bedingt ableiten.[2]
Wechselwirkungen mit anderen Medikamenten
Wechselwirkungen mit anderen Medikamenten wurden bislang nicht systematisch untersucht.
Unerwünschte Wirkungen (Nebenwirkungen)
Zu den häufigeren unerwünschten Wirkungen zählen Parästhesien, Kopfschmerzen, Schwindel, Angst, Müdigkeit, Übelkeit und Schlafstörungen. Bei höheren Dosierungen kann es zum Auftreten von Krampfanfällen, Chorea oder Myoklonie kommen.[3]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Amifampridin blockiert spannungsabhängige Kaliumkanäle reversibel. Der Wirkstoff verhindert so, dass Kaliumionen die Nervenzellen verlassen. Daher verlängert Amifampridin die Depolarisation am präsynaptischen Ende der Nervenzellen. Die Verlängerung der Depolarisation erhöht wiederum mittelbar die Freisetzung des Botenstoffs Acetylcholin in die Synapsen hinein und ermöglicht eine verbesserte Muskelkontraktion.[3]
Toxikologie
Amifampridin wurde bislang nur in beschränktem Umfang toxikologisch untersucht. Vierwöchige Untersuchungen an Ratten und Hunden zeigten mögliche Auswirkungen auf das Zentralnervensystem, Leber, Niere, Muskulatur und die Reizleitung am Atrioventrikularknoten des Herzens. Studien über vier Wochen hinaus sowie Studien zu möglichen Auswirkungen auf Fortpflanzung und Tumorbildung fehlen. Amifampridin ist nicht genotoxisch.
Sonstige Informationen
Geschichtliches
Amifampridin wird seit den 1980er Jahren zur Behandlung des LEMS und anderer neuromuskulärer Krankheiten eingesetzt. Dabei kam der Wirkstoff zumeist in Form einer freien Base zum Einsatz.[4]
Amifampridin wurde 2002 in der EU der Status als mögliches Arzneimittel für seltene Leiden zuerkannt. Ende 2009 erhielt die Firma BioMarin (Novato, USA) die EU-Zulassung für das Fertigarzneimittel Firdapse. Der Wirkstoff in Firdapse ist das Phosphatsalz des Amifampridin. Die Zulassung wurde unter »außergewöhnlichen Umständen« erteilt, da die europäische Zulassungsbehörde davon ausging, dass die Seltenheit der Krankheit LEMS es dem Hersteller nicht ermöglichte, die üblichen Informationen zu Wirksamkeit, Sicherheit und Verträglichkeit vorzulegen.[4] Die Zulassung stützte sich hauptsächlich auf Angaben aus wissenschaftlichen Fachliteratur.
Preis
Im Deutschland wird Amifampridin als NRF 22.3-Rezeptur in Kapseln mit 5 Milligramm (andere Stärken auch herstellbar) in Apotheken hergestellt (Kosten hier für 500 Stück mit 5 Milligramm 639 Euro) oder als Fertigarzneimittel Firdapse (Kosten hier für 100 Stück mit 10 Milligramm 2893,03 Euro) nach Verschreibung durch einen Arzt in Apotheken zubereitet/abgegeben.[5] Für die zugelassene Höchstdosis von 60 mg pro Tag lagen die jährlichen Kosten für die Apothekenzubereitungen zumeist unter 3.000 Euro während die jährlichen Kosten für das Fertigarzneimittels Firdapse bei Einnahme der Tageshöchstdosis in Deutschland knapp 64.000 Euro betragen.[6] Ähnliche Preisanstiege in Großbritannien veranlassten namhafte britische Neurologen, einen offenen Protestbrief an den britischen Premierminister zu senden.[7]
Handelsnamen
Der Handelsname des in der EU zugelassenen Fertigarzneimittels ist Firdapse, nachdem zunächst der Name Zenas vorgesehen war.
Einzelnachweise
- ↑ a b c d e f Datenblatt 3,4-Diaminopyridin bei Sigma-Aldrich, abgerufen am 6. Februar 2011.
- ↑ Bundesinstitut für Arzneimittel und Medizinprodukte (15. Januar 2008). Ergebnisprotokoll der 60. Sitzung des Sachverständigen-Ausschusses für Verschreibungspflicht. Zugegriffen am 6. Februar 2011.
- ↑ a b Europäische Arzneimittelagentur (23. Dezember 2009): Firdapse 10 mg Tabletten. Zusammenfassung der Merkmale des Arzneimittels. Zugegriffen am 6. Februar 2011.
- ↑ a b Europäische Arzneimittelagentur (22. Oktober 2009):Assessment Report for Zenas. International Nonproprietary Name: Amifampridine. Procedure No.: EMEA/H/C/001032. Zugegriffen am 6. Februar 2011.
- ↑ Bundesvereinigung Deutscher Apothekerverbände: Neues Rezeptur-Formularium. Rezepturhinweise: 3,4-Diaminopyridin und 4-Aminopyridin. Govi, Eschborn 2009.
- ↑ Rote Liste online: Firdapse 10 mg Tabletten. Abgerufen am 5. Februar 2011. Zugang nur nach Anmeldung.
- ↑ Nicholl DJ, Hilton-Jones D, Palace J et al. Open letter to prime minister David Cameron and health secretary Andrew Lansley. Br Med J. 2010; 341:c6466, PMID 21081599.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
