- CBX
-
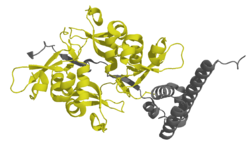
Chromobox Homolog 1 CBX1 Dimer (gelb) mit EMSY, nach PDB 2FMM Vorhandene Strukturdaten: 2fmm Größe 118 aa; 13,73 kDa Struktur Homodimer Precursor (185 aa; 21,4 kDa) Isoformen HP1α, HP1β, HP1γ Bezeichner Gen-Namen CBX1; CBX; HP1 Externe IDs OMIM: 604511 MGI: 105369 Vorkommen Übergeordnetes Taxon Eukaryoten Orthologe Mensch Maus Entrez 10951 n/a Ensembl ENSG00000108468 ENSMUSG00000018666 UniProt P83916 P83917 Refseq (mRNA) NM_006807 NM_007622 Refseq (Protein) NP_006798 NP_031648 Genlocus Chr 17: 43.5 - 43.53 Mb Chr 11: 96.65 - 96.67 Mb PubMed Suche [1] n/a Bei der Familie der Heterochromatin Proteine 1 (HP1) (auch „Chromobox Homolog“, CBX) handelt es sich um hochkonservierte Adaptermoleküle, die eine Vielzahl essentieller Funktionen im Zellkern übernehmen. Hierzu zählen die epigenetische Genregulation, die Aufrechterhaltung der Genomstabilität und die Ausbildung einer „Plattform“ für den Wiederaufbau der Zellkerne in der Endphase der Mitose. Erstmals beschrieben wurde es 1986 von Sarah Elgin in Drosophila melanogaster [1],[2] als ein Protein, welches als mutierte Form mit der Unterdrückung der Positionseffekt-Variegation verbunden ist. 1991 wurde von Prim Singh nachgewiesen, dass HP1 ein hochkonserviertes Protein des Heterochromatin ist und eine fundamentale Rolle in der epigenetischen Regulation spielt[3].
Inhaltsverzeichnis
Isoformen
In Säugetieren gibt es die Isoformen HP1α, HP1β und HP1γ.
HP1β
HP1β interagiert direkt mit der Histon-Methyltransferase Suv(3)9h1 und ist eine Komponente von perizentrischen und telomeren Heterochromatin[4],[5],[6]. HP1β kann Dosis-abhängig Gene auf perizentrischem Heterochromatin stilllegen[7]. Der Prozess des Stilllegens wird durch die Interaktion der HP1β-Chromodomäne und die Histonmodifikation Me(3)K9H3 vermittelt.
Quellen
- ↑ James TC, Elgin SC: Identification of a nonhistone chromosomal protein associated with heterochromatin in Drosophila melanogaster and its gene. Mol Cell Biol 1986, 6:3862-3872
- ↑ Eissenberg, J.C., James, T.C., Foster-Hartnett, D.M., Hartnett, T., Ngan, V.K.W., Craig, C., Elgin, S.C.R. (1990). Mutation in a heterochromatin-specific chromosomal protein are associated with suppression of position-effect variegation in D. melanogaster. J. Cell Biol. 111(5/2): 5a.
- ↑ Singh PB, Miller JR, Pearce J, Kothary R, Burton RD, Paro R, James TC, Gaunt SJ. A sequence motif found in a Drosophila heterochromatin protein is conserved in animals and plants. Nucleic Acids Res. 1991 Feb 25;19(4):789-94
- ↑ Aagaard L, Laible G, Selenko P, Schmid M, Dorn R, Schotta G, Kuhfittig S, Wolf A, Lebersorger A, Singh PB, Reuter G, Jenuwein T. Functional mammalian homologues of the Drosophila PEV-modifier Su(var)3-9 encode centromere-associated proteins which complex with the heterochromatin component M31. EMBO J. 1999 Apr 1;18(7):1923-38.
- ↑ Wreggett KA, Hill F, James PS, Hutchings A, Butcher GW, Singh PB; A mammalian homologue of Drosophila heterochromatin protein 1 (HP1) is a component of constitutive heterochromatin. Cytogenet Cell Genet. 1994;66(2):99-103.
- ↑ Sharma GG, Hwang KK, Pandita RK, Gupta A, Dhar S, Parenteau J, Agarwal M, Worman HJ, Wellinger RJ, Pandita TK. Human heterochromatin protein 1 isoforms HP1(Hsalpha) and HP1(Hsbeta) interfere with hTERT-telomere interactions and correlate with changes in cell growth and response to ionizing radiation. Mol Cell Biol. 2003 Nov;23(22):8363-76.
- ↑ Festenstein R, Sharghi-Namini S, Fox M, Roderick K, Tolaini M, Norton T, Saveliev A, Kioussis D, Singh P; Heterochromatin protein 1 modifies mammalian PEV in a dose- and chromosomal-context-dependent manner. Nat Genet. 1999 Dec;23(4):457-61.
Literatur
Singh PB, Georgatos SD. HP1: facts, open questions, and speculation. J Struct Biol. 2002 Oct-Dec;140(1-3):10-6. Review
Weblinks
Wikimedia Foundation.