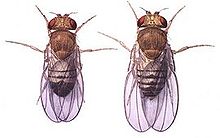
- Drosophila melanogaster
-
Schwarzbäuchige Taufliege 
Schwarzbäuchige Taufliege (Drosophila melanogaster) (Männchen)
Systematik Überordnung: Neuflügler (Neoptera) Ordnung: Zweiflügler (Diptera) Unterordnung: Fliegen (Brachycera) Familie: Taufliegen (Drosophilidae) Gattung: Drosophila Art: Schwarzbäuchige Taufliege Wissenschaftlicher Name Drosophila melanogaster Meigen, 1830 Drosophila melanogaster, die „Schwarzbäuchige“ Taufliege ist einer der am besten untersuchten Organismen der Welt. Zusammen mit über 700 weiteren Arten gehört sie zur Familie der Taufliegen (Drosophilidae). Die Bezeichnung Schwarzbäuchige Fruchtfliege für dieses Tier ist relativ neu und taucht in der deutschsprachigen Literatur erst nach 1960 auf. Es dürfte sich beim Begriff „Fruchtfliege“ um eine fälschlicherweise Wort für Wort vorgenommene Übersetzung des englischen Trivialnamens „fruit fly“ handeln, also um einen Falschen Freund. „Fruchtfliegen“ waren und sind im deutschen Sprachgebrauch nämlich die Vertreter der Familie Tephritidae.[1] „Schwarzbäuchig“ ist die nachträgliche Rückübersetzung des wissenschaftlichen Artnamens, um dem Tier einen deutschen Namen zu geben.
Drosophila melanogaster wurde erstmals 1830 von Johann Wilhelm Meigen beschrieben. Als geeigneten Versuchsorganismus nutzte sie 1901 zuerst der Zoologe und Vererbungsforscher William Ernest Castle. Er untersuchte an Drosophila-Stämmen die Wirkung von Inzucht über zahlreiche Generationen und die nach Kreuzung von Inzuchtlinien auftretenden Effekte. 1910 begann Thomas Hunt Morgan ebenfalls, die Fliegen im Labor zu züchten und systematisch zu untersuchen. Seitdem haben viele andere Genetiker an diesem Modellorganismus wesentliche Erkenntnisse zur Anordnung der Gene in den Chromosomen des Genoms dieser Fliege gewonnen.
Inhaltsverzeichnis
Beschreibung
Drosophila melanogaster war ursprünglich eine tropische und subtropische Art. Sie hat sich jedoch mit dem Menschen gemeinsam über die ganze Welt verbreitet und überwintert in Häusern. Die Weibchen sind etwa 2,5 Millimeter lang, die Männchen sind etwas kleiner. Letztere sind leicht an ihrem stärker abgerundeten, durch Melanine fast einheitlich dunkel gefärbten Hinterleib von den Weibchen unterscheidbar, die in der Aufsicht einen spitzeren Hinterleib besitzen und die schwarzen Melanine mehr in Form eines Querstreifenmusters in die Körperdecke (Cuticula) ihres Hinterendes eingelagert haben. Die Augen der kleinen Fliegen sind durch Einlagerung von braunen Ommochromen und roten Pterinen in typischer Weise rot gefärbt.
Lebenszyklus
Die Weibchen legen insgesamt etwa 400 weißlich-gelbliche, von einem Chorion und einer Vitellinmembran umhüllte Eier, die etwa einen halben Millimeter groß sind, auf Obst und verfaulendem, gärendem organischen Material ab. Die Dauer der Entwicklungszeit hängt von der Umgebungstemperatur ab. Bei einer Temperatur von 25 °C schlüpft aus jedem Ei nach etwa 22 Stunden als Larve eine wurmartige Made, die sich sofort auf die Suche nach Futter macht. Die Nahrung besteht in erster Linie aus den Mikroorganismen, die das Obst zersetzen, wie zum Beispiel Hefen und Bakterien, und erst in zweiter Linie aus dem zuckerhaltigen Obst selbst. Nach etwa 24 Stunden häutet sich die Larve, die ständig wächst, zum ersten Mal, und erreicht das zweite Larvenstadium. Nach dem Durchlaufen von drei Larvenstadien und einem viertägigen Puppenstadium schlüpft bei 25 °C nach insgesamt neun Tagen Entwicklungszeit das flugfähige Insekt.
Drosophila als Forschungsobjekt der Genetik
Die Fliege als Untersuchungsobjekt der klassischen Genetik
Drosophila melanogaster wurde in der ersten Hälfte des 20. Jahrhunderts durch die Forschungen des amerikanischen Zoologen und Genetikers Thomas Hunt Morgan und seiner Schule zum Versuchstier der klassischen Genetik. Diese Art hat nur vier verschiedene Chromosomen, die in den Drosophila-Zellen paarweise vorkommen: ein Paar Geschlechtschromosomen, die auch als erstes Chromosom oder X- bzw. Y-Chromosom bezeichnet werden, und drei Paar Autosomen, die als zweites, drittes und viertes Chromosom bezeichnet werden. Das vierte Chromosom ist jedoch nur sehr klein und enthält nur wenige Gene. Ideal für die Forschung ist auch, dass die Zucht einer großen Anzahl von Fliegen in Flaschen leicht möglich und die Generationenfolge kurz ist. „Eine halbe Milchtüte mit einem Stück verfaulender Banane genügte, um zweihundert Taufliegen vierzehn Tage lang bei Laune zu halten“, schreibt Martin Brookes in seinem 2002 erschienenen Buch über Drosophila. So hat man eine sehr große Anzahl von Kreuzungsexperimenten mit den Taufliegen durchführen können. Dabei wurden Kopplungsgruppen von Genen, die auf ein und demselben Chromosom sitzen, festgestellt, das Phänomen des Crossing Over entdeckt und auch etliche Mutanten beschrieben und näher untersucht, etwa Fliegen mit weißen statt mit roten Augen oder Exemplare mit Stummelflügeln, die flugunfähig sind. Hermann Muller war der erste, der die mutationsauslösende Wirkung von Röntgenstrahlen auf die Erbsubstanz der Taufliege erkannte. Seitdem wurden die harten Strahlen eingesetzt, um bei den Fliegen eine Vielzahl von unterschiedlichen Mutationen auszulösen.
Die Popularität von Drosophila als Modellorganismus hielt zunächst bis in die 1940er Jahre an.
Ergebnisse der Sequenzanalyse
Im Jahr 2000 wurde die Sequenzierung des Genoms abgeschlossen. Insgesamt 139.731.881 Basenpaare und etwa 13.600 unterschiedliche Gene wurden dabei ermittelt. Diese erste Schätzung muss nach zehn Jahren revidiert werden, da man inzwischen 19.806 Gene kennt. Viele dieser Gene haben zum Teil erstaunliche Ähnlichkeit mit den Genen des Menschen. Forscher haben herausgefunden, dass etwa 70 Prozent der menschlichen Gene, die im Zusammenhang mit Krebs beschrieben wurden und im Verdacht stehen, in mutiertem Zustand an der Krebsentstehung beteiligt zu sein, auch im Erbgut der Taufliege vorkommen.[2][3][4]
Entwicklungsbiologische Forschungen
Auch im Rahmen entwicklungsbiologischer Untersuchungen hat man an den Embryonalstadien der Taufliegen zahlreiche Erkenntnisse gewinnen können. Schon um 1900 war der Harvard-Professor William Ernest Castle der erste, der auf der Suche nach einem Organismus, der sich als Objekt für embryologische Studien eignete, auf die Taufliege stieß. Seitdem hat sich auf diesem Gebiet viel getan. In den 1970er Jahren begann sich Christiane Nüsslein-Volhard mit den Entwicklungsgenen von Drosophila zu beschäftigen. Die Entwicklung der Fliege vom Ei bis zum Imago wird über eine Genkaskade verschiedener Gengruppen gesteuert. Dabei beeinflussen die früher in dieser Genkaskade auftretenden Gengruppen jeweils die zeitlich nachfolgenden, nicht jedoch umgekehrt. An erster Stelle stehen die bereits während der Oogenese in Eizelle, Nährzellen und Follikelzellen exprimierten maternalen Koordinatengene. Auf diese folgen während der larvalen Entwicklung zuerst die Lückengene, dann die Paarregelgene und schließlich die Segmentpolaritätsgene. Die homöotischen Gene sorgen zuletzt für die Entwicklung der Organe in den entsprechenden Segmenten. 1980 veröffentlichte sie ihre bahnbrechende Studie über die „Mutationen, die Zahl und Polarität der Segmente bei Drosophila beeinflussen“, für die sie 1995 zusammen mit Eric Wieschaus und Edward Lewis den Nobelpreis für Physiologie oder Medizin erhielt.
Vorteile von Drosophila als Modellorganismus
Drosophila ist eine Fliegenart, die sehr einfach und billig zu züchten ist. In der Genforschung wird Drosophila bevorzugt als Forschungsobjekt verwendet, weil sie eine kurze Generationsfolge (etwa 9–14 Tage) aufweist, aus einer Generation bis zu 400 Nachkommen entspringen, jedes Individuum nur vier Chromosomenpaare besitzt und weil die Art viele leicht erkennbare Genmutationen zeigt. Mit dem Gal4/UAS-System steht ein genetisches Werkzeug zur Verfügung, welches die Expression beliebiger Gene in spezifisch ausgewählten Zellen erlaubt.
Verwendung als Lebendfutter
Neben der Verwendung in der Genetik ist Drosophila auch als Futtertier beliebt, zum Beispiel zur Fütterung von Fischen oder kleinen Reptilien und Amphibien. Dabei werden vor allem flugunfähige Mutanten verwendet, die einfacher zu handhaben sind.
Entwicklung
Embryonalentwicklung
 Kutikula eines 22 Stunden alten Embryos
Kutikula eines 22 Stunden alten Embryos
Nach der Befruchtung des Drosophila-Eis und der Verschmelzung der Zellkerne erfolgen mehrere schnell aufeinander folgende synchrone Kernteilungen (Mitosen), bei denen eine Abgrenzung durch Zellmembranen unterbleibt. So entsteht ein Embryo, der aus einer Zelle mit vielen Zellkernen besteht, die nicht durch Membranen abgegrenzt werden. Dieser Zustand wird als synzytiales Blastoderm bzw. als polyenergid (mehrkernig) bezeichnet. Bereits nach der siebten Kernteilung wandern die meisten Kerne an die Peripherie des Embryos, also unter die äußere Zellmembran. Zwischen der achten und neunten Kernteilung werden acht bis zehn Zellkerne in das posteriore Polplasma eingeschlossen und beginnen sich daraufhin unabhängig von den anderen Kernen zu teilen. Aus diesen so genannten Polzellen entwickeln sich die Keimzellen. Aus dem synzytialen Blastoderm entsteht etwa 2,5 Stunden nach der Eiablage das „zelluläre Blastoderm“, und zwar durch Einstülpung und Wachstum der äußeren Zellmembran in die Regionen zwischen den einzelnen Kernen. Damit wird das erste einschichtige Epithel der entstehenden Fliege gebildet und den Zellkernen der Zugang zu asymmetrisch verteilten, morphogenen Genprodukten verwehrt (siehe zum Beispiel bicoid). Entsprechend ist das Entwicklungspotential der Zellen zu diesem Zeitpunkt in Abhängigkeit von ihrer Position bereits weitgehend festgelegt. Eine ventrale Einfurchung entlang der Längsachse (Ventralfurche) leitet die Gastrulation ein, durch die das Blastodermepithel in drei Keimblätter aufgeteilt wird: Durch die ventrale Einfurchung, die an der „Bauchseite“ längs des Embryos erfolgt, entsteht die Mesodermanlage. Eine anterior der Ventralfurche stattfindende Invagination, die das Stomodeum bildet, und eine am posterioren Pol des Embryos stattfindende Invagination, die das Proktodeum bildet, grenzen das spätere Entoderm ab. Die an der Außenseite des Embryos verbleibenden Zellen und die Endbereiche der stomodealen und proktodealen Invaginationen bilden das Ektoderm. Mit der Verlängerung des Keimstreifs wandern die Polzellen von posterior in das Innere des Embryos. Die Organogenese setzt ein und zum ersten Mal wird eine embryonale Metamerie erkennbar. Etwa 7,5 Stunden nach der Befruchtung beginnt die Keimstreifverkürzung, die mit dem Dorsalschluss (dorsal closure) endet. Nach weiteren Differenzierungsschritten schlüpft etwa 21 Stunden nach der Befruchtung die vollständig entwickelte Larve.
Larvalentwicklung
Die fußlosen, segmentierten Maden besitzen an ihrem etwas stärker zugespitzten Vorderende einen dunklen Chitin-Stift, der ausgestreckt und eingezogen werden kann und die recht kümmerlichen Mundwerkzeuge enthält. Die Larven kriechen im Nahrungsbrei oder in der Umgebung der Nahrungsquelle herum, fressen und wachsen innerhalb weniger Tage von der Größe des Eis (0,5 mm) bis zur Größe der Fliege (2,5 mm) heran. Sie häuten sich in dieser Zeit zweimal. Es werden dementsprechend drei Larvenstadien unterschieden.
Verpuppung
Das letzte Larvenstadium stellt bald das Herumkriechen ein und verpuppt sich. Dieses Entwicklungsstadium färbt sich nach und nach braun, ähnelt bei Drosophila aber nicht einer typischen Insektenpuppe, sondern sieht eher wie eine verschrumpelte und vertrocknete Made aus. Im Inneren der Madenhaut entwickelt sich nämlich eine Tönnchenpuppe, deren Hülle aus verhärteter Larvenhaut besteht. Nach einigen Tagen platzt ein Deckel am Ende des Tönnchens auf, und eine fertig entwickelte Taufliege kriecht heraus, die ihre Körperdecke nachträglich noch etwas verfärbt und aushärtet und ihre Flügel ausrichtet.
Festlegung des Geschlechts
Die Geschlechtsbestimmung der Taufliege ist (wie bei vielen Tieren üblich) genetisch bedingt. Ebenso wie beim Menschen besitzt Drosophila zwei Geschlechtschromosomen: Weibchen haben zwei X-Chromosomen, Männchen ein X- und ein Y-Chromosom. Anders als beim Menschen jedoch trägt das Y-Chromosom keine geschlechtsbestimmende Komponente, vielmehr ist das Verhältnis der X-Chromosomen zu den Autosomen geschlechtsbestimmend.[5] Liegt das Verhältnis bei größer oder gleich 1, so entsteht ein Weibchen, ist es kleiner oder gleich 0,5, entsteht ein Männchen. Mutanten mit dazwischenliegenden Verhältnissen, etwa bei triploidem Autosomensatz und XX (Verhältnis=0,67) bilden Intersexe aus mit mosaikartig verteilten männlichen und weiblichen Merkmalen (sogenanntes „Salz-und-Pfeffer-Muster“). Das Geschlecht wird demnach von jeder Zelle selbst festgelegt und ist bei nicht eindeutigen Gendosen jeweils unterschiedlich. Die Kompensation der unterschiedlichen Gendosen bei den X-Chromosomen erfolgt beim Männchen durch eine stark erhöhte Transkriptionsrate nicht geschlechtsbestimmender Gene. Dies geschieht über eine Hyper-Acetylierung des Histons H4, wodurch die DNA weniger stark an die Nukleosomen gebunden ist und somit leichter abgelesen werden kann.
Die Entscheidung, welche geschlechtsspezifischen Gene wie transkribiert werden, wird über das Gen sex lethal (Sxl) gesteuert. Bei Weibchen ist Sxl aktiv, bei Männchen inaktiv. Sxl selbst ist ein RNA-spleißendes Enzym, das die sogenannte Transformer mRNA spleißt. Das entstehende Protein „Transformer“ ist ebenfalls ein Spleißfaktor, welcher die mRNA des Gens double sex (dsx) spleißt. Dsx bewirkt dann die eigentliche Geschlechtsfestlegung auf molekularer Ebene, und zwar ebenfalls als Transkriptionsfaktor. Das Protein dsx gibt es in einer männlichen und weiblichen Variante. Weibchen: sxl aktiv, tra aktiv, dsxF (female) entsteht. Die Realisatorgene des männlichen Geschlechts werden reprimiert. Männchen: sxl inaktiv, tra inaktiv, dsxM (Male) entsteht. Die Realisatorgene des weiblichen Geschlechts werden reprimiert.Der Zusammenhang zwischen Aktivität von „sex lethal“ und der X-Chromosomen-Dosis erklärt sich nun folgendermaßen: Auf dem X-Chromosom werden 3 Gene für Transkriptionsfaktoren im syncytialen Blastoderm aktiviert, die auch „Numeratorgene“ genannt werden (Bsp.: sisterless). Auf den Autosomen sind hingegen Gene kodiert, die man „Denominatorgene“ nennt (Bsp.: deadpan). Diese binden an den sogenannten early promoter, eine regulatorische Region vor dem Sxl-Gen und aktivieren es.
Das Verhältnis X-Chromosomen:Autosomen ist somit ein Verhältnis der Numeratorgene zu Denominatorgenen. Liegt ein weiblicher Chromosomensatz vor (XX) überwiegen die Numeratorgene und aktivieren die Sxl-Transkription. Bei einem männlichen Satz (XY) sind die Denominatoren in Überzahl, die Transkription von Sxl wird reprimiert. Sxl ist im Entwicklungsverlauf somit inaktiv.
Das Sxl-Gen besitzt zusätzlich einen late promoter. Dieser ist in der späteren Entwicklung konstitutiv in beiden Geschlechtern aktiviert. Durch eine Autoregulation von Sxl, bleibt das Level an Sxl-Protein in Weibchen hoch, in Männchen niedrig. In einer weiblichen Fliege aktiviert (durch Spleißen der Sxl mRNA) frühes Sxl-Protein späte Sxl-prä-mRNA. Die Translation ist somit möglich. Es entsteht weiteres aktives Sxl-Protein. In männlichen Zellen ist die Konzentration an frühem Sxl-Protein nahezu null. Das bedeutet späte Sxl-mRNA wird nicht gespleißt, die Translation ist dadurch unvollständig, das entstehende Protein ist inaktiv. Das Exon3 des Sxl-Transkriptes enthält ein STOP-Codon. Ist aktives Sxl vorhanden (XX), wird dieses Exon ausgespleißt. Sxl bindet hierfür an Poly(U)-Sequenzen in den flankierenden Introns. Das Exon3 wird dadurch nicht mehr als Exon erkannt und gespleißt.
In Drosophila ist die Geschlechtsbestimmung somit Zellautonom. Jede Zelle „zählt“ ihr X:A Verhältnis und entwickelt sich dementsprechend.
Drosophila-Forschungsgemeinschaft
In den USA findet in wechselnden Städten jährlich die größte internationale Drosophila-Konferenz statt. Sie hat etwa 2000 Teilnehmer. Die europäische Drosophila-Konferenz hat im Schnitt 400 bis 500 Teilnehmer und findet alle zwei Jahre in wechselnden europäischen Ländern statt. Eine kleine deutsche regionale Tagung gibt es jährlich. Des Weiteren ist Drosophila als Forschungsobjekt auf vielen internationalen Life Science-, Entwicklungsbiologie-, Neurobiologie- und weiteren Tagungen vertreten.
Mutationen
Die Züchtungen in den wissenschaftlichen Laboratorien haben eine Unzahl von Mutationen hervorgebracht. In systematischen Screens wurde inzwischen ein Großteil der etwa 13400 Gene mutiert.
Literatur
- Peter A. Lawrence: The making of a fly. The genetics of animal design. Blackwell Science, ISBN 0-632-03048-8
- Robert E. Kohler: Lords of the fly. Drosophila Genetics and the Experimental Life. University of Chicago Press, 1994. ISBN 0226450627
- Rubin GM, Lewis EB.: A brief history of Drosophila's contributions to genome research. Science 2000, 287 S. 2216-8.
- Martin Brookes: Drosophila – Die Erfolgsgeschichte der Fruchtfliege, Rowohlt Verlag, Hamburg 2002, ISBN 3-498-00622-3
- Karl-Friedrich Fischbach: Funktionelle Differenzierung und Wechselwirkungen der Rezeptorsysteme im Komplexauge von Drosophila melanogaster. Freiburg 1976.
Einzelnachweise
- ↑ Kéler, Stefan von: Entomologisches Wörterbuch. Akademie-Verlag, Berlin 1963.
- ↑ MapViewer Eintrag
- ↑ Proteom bei UniProt
- ↑ Adams MD, Celniker SE, Holt RA, et al.: The genome sequence of Drosophila melanogaster. In: Science. 287, Nr. 5461, März 2000, S. 2185–2195. PMID 10731132.
- ↑ Penalva LO, and Sanchez L.: RNA binding protein sex-lethal (Sxl) and control of Drosophila sex determination and dosage compensation. Microbiol Mol Biol Rev. 2003 Sep;67(3):343-59, table of contents. PMID 12966139
Weblinks
 Commons: Drosophila melanogaster – Album mit Bildern und/oder Videos und Audiodateien
Commons: Drosophila melanogaster – Album mit Bildern und/oder Videos und Audiodateien- Flymove – Schulausgabe auch auf Deutsch
- Flybase (englisch)
- Interactive Fly (englisch)
- www.wissenschaft.de: Reaktion auf Alkohol liegt bei Drosophila in den Genen
- Tips zur Zucht von Drosphila melanogaster
Wikimedia Foundation.