- Cer(IV)-oxid
-
Kristallstruktur 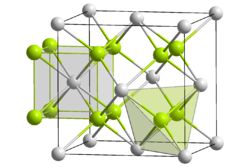
__ Ce4+ __ O2− Kristallsystem kubisch
Raumgruppe Allgemeines Name Cer(IV)-oxid Andere Namen Cerdioxid
Verhältnisformel CeO2 CAS-Nummer 1306-38-3 PubChem 73963 Kurzbeschreibung hellgelber Feststoff[2]
Eigenschaften Molare Masse 172,11 g·mol−1 Aggregatzustand fest
Dichte 7,3 g·cm−3[3]
Schmelzpunkt Löslichkeit unlöslich in Wasser[4]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cer(IV)-oxid oder Cerdioxid ist ein Oxid des Seltenerd-Metalls Cer. Neben diesem existiert auch Cer(III)-oxid (Ce2O3) und das dunkelblaue Mischoxid Cer(III,IV)-oxid (Ce3O4). Im Jahr 1808 zeigte der englische Chemiker Sir Humphry Davy, dass die seltene Erde Ceria (Cerit) kein Element, sondern eine Verbindung aus metallischem Element, Silicium und Sauerstoff ist. Zwischen 1839 und 1843 gelang Carl Gustav Mosander die Auftrennung und der Nachweis, dass es sich um eine Mischung verschiedener Metalloxide mit Siliciumdioxid bzw. ein Inselsilikat handelt ((Ce,La,Ca)9(Fe3+,Mg)[(OH)3|SiO3(OH)|(SiO4)6]).[7]
Inhaltsverzeichnis
Eigenschaften
Wie alle Oxide der seltenen Erden emittiert Cer(IV)-oxid beim Erhitzen ein starkes Licht. Es kristallisiert in der Fluorit-Struktur. In reinster Form ist das Oxid cremefarben bis hellgelb. Sind darin Verunreinigungen enthalten (z. B. Neodym, Praseodym) so kann das Oxid auch braune Farbtöne annehmen. Die braune Farbe hat meistens Cerdioxid, das für Schleif- und Polierzwecke eingesetzt wird. Hierbei ist die Reinheit ohne Bedeutung.
Reaktionen
Cer(IV)-oxid bildet sich durch Erhitzen von Cer(III)-nitrat, Ce(NO3)3 oder Cer(III)-oxalat Ce2(C2O4)3.
Unter Erhitzen entsteht bei der Umsetzung von Cerdioxid mit konz. Schwefelsäure Cer(IV)-sulfat:
Verwendung
Katalysator
Cer(IV)-oxid wird in Katalysatoren von Kraftfahrzeugen eingesetzt und oxidiert bei Sauerstoffmangel Kohlenstoffmonoxid und überschüssige Kohlenwasserstoffe gemäß:
Bei Sauerstoffüberschuss im Abgas reaktiviert sich der Katalysator wieder:
Glühstrümpfe
Eine optimale Lichtausbeute lässt sich aus einer Mischung von ca. 99 % Thorium(IV)-oxid und 1 % Cer(IV)-oxid erzielen. Dies wird bei der Herstellung von Glühstrümpfen für Gaslampen (Gasglühlicht oder Auerlicht) ausgenutzt, indem diese in die entsprechenden Nitratlösungen getränkt werden. Beim Anbrennen entstehen dann die Oxide, die für die hohe Lichtausbeute sorgen.
Schleifmittel
Auf Cer(IV)-oxid basierendes Poliermittel wird als Opaline in der optischen Industrie zur Politur von Gläsern eingesetzt. Es wird normalerweise als trockenes, weißes Pulver geliefert und weist eine Dichte von etwa 1,6 g/cm³ auf. Die mittlere Korngröße beträgt etwa 1 µm. Die Poliersuspension, die mit entionisiertem Wasser hergestellt wird, enthält ungefähr 60 g Opaline pro Liter Wasser.[8]
Analog dazu werden Cer(IV)-oxid basierende Poliersuspension auch in der Halbleitertechnik eingesetzt. Sie kommen vor allem bei der chemisch-mechanischen Politur (CMP) von Siliciumdioxid zum Einsatz. Die mittlere Korngröße ist hierbei jedoch deutlich geringer, sie liegt nur bei etwa 50 bis 150 nm. Da die Cer(IV)-oxid-Partikel relativ schnell sedimentieren, werden organische Zusätze, wie Polyelektrolyte, zur Stabilisierung der Suspension eingesetzt. Weiterhin gibt es kommerzielle Produkte, die weitere organische Stoffe, wie bestimmte Aminosäuren, nutzen, um eine erhöhte Materialselektivität zwischen den Abtragsraten von Siliciumdioxid- und -nitrid zu erreichen. Hintergrund ist, dass Siliciumnitridschichten bei der SiO2-CMP als Stoppschicht eingesetzt werden und bei der Politur möglichst nicht abgetragen werden sollen.
Weitere
Für zukünftige Herstellung von Wasserstoff mittels Sonnenergie wird das Cer(IV)-oxid-Cer(III)-oxid-Verfahren entwickelt.
CeO2 findet außerdem bei Lacken als UV-Absorber Verwendung.[9] Dies dient der Verbesserung der Lichtbeständigkeit von exponierten Oberflächen; Lacke werden sonst durch die UV-Strahlung zersetzt.
Literatur
- Trust, Paul u. Schimmels, Michael: Einführung in die Chemie – auf einfachster Grundlage; Teil II; 2. Auflage, Franz Steiner Verlag GmbH, Wiesbaden (1956).
- The New Encyclopæedia Britannica; Macropæedia Vol. 15; 15th Ed.; Encyclopedia Britannica, Inc. (1974).
Einzelnachweise
- ↑ W. H. Weber, K. C. Hass, J. R. McBride: Raman study of CeO_{2}: Second-order scattering, lattice dynamics, and particle-size effects. In: Physical Review B. 48, Nr. 1, 1. Juni 1993, S. 178–185, doi:10.1103/PhysRevB.48.178.
- ↑ Datenblatt Cer(IV)-oxid bei AlfaAesar, abgerufen am 5. April 2010 (JavaScript erforderlich).
- ↑ a b Eintrag zu Cer(IV)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Januar 2008 (JavaScript erforderlich).
- ↑ a b c Datenblatt Cer(IV)-oxid bei Merck, abgerufen am 18. Januar 2011.
- ↑ Datenblatt Cer(IV)-oxid bei Sigma-Aldrich, abgerufen am 12. Juni 2011.
- ↑ United States National Library of Medicine
- ↑ Mineralienatlas: Cerit
- ↑ Reinhard Conradt, Ulf Dahlmann, Sonja-Michaela Groß, Fritz Klocke, Stefan Hambücker: Optimierung der chemischen Einflüsse bei der mechanischen Politur von Glas.Abschlussbericht zum Forschungsvorhaben in Zusammenarbeit mit der Arbeitsgemeinschaft industrieller Forschung e.V., Institut für Gesteinshüttenkunde Fraunhofer Institut für Produktionstechnologie, 2001 (online, AiF-Vorhaben: 12063 N).
- ↑ Nanotechnologie und nano-basierte Additive in Lacken
Kategorien:- Cerverbindung
- Oxid
Wikimedia Foundation.




