- Osteolytische Knochenmetastase
-
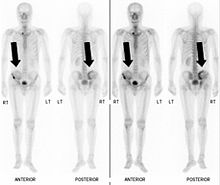
 61-jähriger Patient mit einem sarkomatoiden hepatozellulären Karzinom (HCC) und einer Metastase am oberen Darmbein, in der Nähe des Iliosakralgelenks. In dieser Röntgenaufnahme ist die osteolytische Läsion mit weißen Pfeilen dargestellt.
61-jähriger Patient mit einem sarkomatoiden hepatozellulären Karzinom (HCC) und einer Metastase am oberen Darmbein, in der Nähe des Iliosakralgelenks. In dieser Röntgenaufnahme ist die osteolytische Läsion mit weißen Pfeilen dargestellt.
Osteolytische Knochenmetastasen sind mit einem Anteil von etwa 75 % die häufigsten Knochenmetastasen.[1]:11 Knochenmetastasen entstehen fast ausschließlich im Markraum.[1] Die Primärtumoren sind meist Nieren-, Lungen-, Brust- oder Schilddrüsenkarzinome.[2] Das stark osteolytische multiple Myelom wird im deutschsprachigen Raum nicht zu den Knochenmetastasen gerechnet.[1]:25
Transformierende Wachstumsfaktoren (Transforming growth factor, TGF) wie beispielsweise TGF-β[3][4] sind in die Knochenmatrix eingelagert. Das Skelettsystem ist der größte Vorratsspeicher für TGF-β. Die Tumorzellen der Knochenmetastasen sezernieren ein dem Parathormon (PTH) verwandtes Peptid, PTHrP (parathyroid hormone-related protein), das die gleiche Wirkung wie Parathormon aufweist, sowie Interleukin-11 (IL-11). Beide Proteohormone stimulieren die Osteoklasten, wodurch der Knochenabbau voranschreitet, sowie die Freisetzung von Wachstumsfaktoren, die ursprünglich in der Knochenmatrix immobilisiert waren. Diese Wachstumsfaktoren regen wiederum die Tumorzellen zur Proliferation an. Dadurch entsteht ein Teufelskreis (Circulus vitiosus) aus Tumorprogredienz und pathologischem Knochenumbau, der einen wesentlichen Anteil an der Unheilbarkeit der meisten Knochenmetastasen hat.[5][6] Ein weiterer Faktor, der das Wachstum der Knochenmetastasen begünstigt, ist der Sauerstoffmangel (Hypoxie) im Bereich der Tumorzellen.[6]
Der TGF-β-Signalweg wird durch die Anbindung von TGF-β an den TGF-Typ-II-Rezeptor (TRII, bzw. TGF-IIR) aktiviert und eine Annäherung an den TGF-Typ-I-Rezeptor (TRI, bzw. TGF-IR) ermöglicht. Die beiden Rezeptoren dimerisieren und aktivieren eine in TRI enthaltene Kinase-Domäne,[5] an die sich die Rezeptor-assoziierten Smad2 und Smad3 (Smad = Mothers against decapentaplegic homolog[7][8]) anlagern. Smad2 und Smad3 werden phosphoryliert und bilden zusammen den Transkriptionsfaktor Smad4. Smad4 überträgt dann das TGF-β-vermittelte Signal bis in den Zellkern, wo die Ziel-Gene aktiviert werden.[9][10][11] TGF-β stimuliert über diesen Signalweg nicht nur das PTHrP- und IL-11-Gen, sondern darüber hinaus weitere für die Kolonisierung im Knochen wichtige Gene. Dazu gehören unter anderem CTGF (connective tissue growth factor), Interleukin-8,[12] CXCR4 (CXC-Motiv-Chemokinrezeptor 4) und MMP1 (Matrixmetallopeptidase 1).[13] Im Tiermodell Maus konnte durch eine Blockade des TGF-β-Signalwegs die Anzahl an Knochenmetastasen reduziert und die Überlebensrate erhöht werden, während eine Überexprimierung von TRI diesen Effekt umkehrt.[14][6] Die gleichen positiven Effekte wurden bei der Unterbrechung der TGF-β-Signalkaskade durch Gen-Knockout von Smad4[15][16] oder durch Überexpression vom Smad7[17], einem proteinogenen Inhibitor, und verschiedenen Wirkstoffen[18][19][20][21][22] mit inhibierender Wirkung beobachtet.[6]

Bitte den Hinweis zu Gesundheitsthemen beachten! Einzelnachweise
- ↑ a b c S. Braun: Operative Therapie und Prognose bei Patienten mit skelettären Karzinommetastasen. Dissertation, Ludwig-Maximilians-Universität zu München, 2004.
- ↑ G. S. Forbes, R. A. McLeod, R. R. Hattery: Radiographic manifestations of bone metastases from renal carcinoma. In: AJR. American journal of roentgenology Band 129, Nummer 1, Juli 1977, S. 61–66, ISSN 0361-803X. PMID 409145.
- ↑ M. Oft, K. H. Heider, H. Beug: TGFbeta signaling is necessary for carcinoma cell invasiveness and metastasis. In: Current biology Band 8, Nummer 23, November 1998, S. 1243–1252, ISSN 0960-9822. PMID 9822576.
- ↑ D. R. Welch, A. Fabra, M. Nakajima: Transforming growth factor beta stimulates mammary adenocarcinoma cell invasion and metastatic potential. In: Proceedings of the National Academy of Sciences of the United States of America Band 87, Nummer 19, Oktober 1990, S. 7678–7682, ISSN 0027-8424. PMID 2217201. PMC 54811.
- ↑ a b G. R. Mundy: Metastasis to bone: causes, consequences and therapeutic opportunities. In: Nature reviews. Cancer Band 2, Nummer 8, August 2002, S. 584–593, ISSN 1474-175X. doi:10.1038/nrc867. PMID 12154351. (Review).
- ↑ a b c d L. K. Dunn, K. S. Mohammad, P. G. Fournier, C. R. McKenna, H. W. Davis, M. Niewolna, X. H. Peng, J. M. Chirgwin, T. A. Guise: Hypoxia and TGF-beta drive breast cancer bone metastases through parallel signaling pathways in tumor cells and the bone microenvironment. In: PloS one Band 4, Nummer 9, 2009, S. e6896, ISSN 1932-6203. doi:10.1371/journal.pone.0006896. PMID 19727403. PMC 2731927. (Open Access)
- ↑ Die Bezeichnung Mothers against decapentaplegic homolog ist von Drosophila mothers against dpp (MAD; dpp = decapentaplegisches Protein) abgeleitet und ist an die Bezeichnung wohltätiger Organisationen, wie beispielsweise Mothers Against Drunk Driving, angelehnt.
- ↑ K. Unsicker: Molekulare Liberos. In: Ruperto Carola Universität Heidelberg, Ausgabe 3, 2001
- ↑ J. Massagué, J. Seoane, D. Wotton: Smad transcription factors. In: Genes & development Band 19, Nummer 23, Dezember 2005, S. 2783–2810, ISSN 0890-9369. doi:10.1101/gad.1350705. PMID 16322555. (Review).
- ↑ Transformierender Wachstumsfaktor β (TGF-β) In: DermoTopics Ausgabe 1, 2002
- ↑ S. M. Kakonen, K. S. Selander, J. M. Chirgwin, J. J. Yin, S. Burns, W. A. Rankin, B. G. Grubbs, M. Dallas, Y. Cui, T. A. Guise: Transforming growth factor-beta stimulates parathyroid hormone-related protein and osteolytic metastases via Smad and mitogen-activated protein kinase signaling pathways. In: The Journal of biological chemistry Band 277, Nummer 27, Juli 2002, S. 24571–24578, ISSN 0021-9258. doi:10.1074/jbc.M202561200. PMID 11964407.
- ↑ M. S. Bendre, A. G. Margulies, B. Walser, N. S. Akel, S. Bhattacharrya, R. A. Skinner, F. Swain, V. Ramani, K. S. Mohammad, L. L. Wessner, A. Martinez, T. A. Guise, J. M. Chirgwin, D. Gaddy, L. J. Suva: Tumor-derived interleukin-8 stimulates osteolysis independent of the receptor activator of nuclear factor-kappaB ligand pathway. In: Cancer research Band 65, Nummer 23, Dezember 2005, S. 11001–11009, ISSN 0008-5472. doi:10.1158/0008-5472.CAN-05-2630. PMID 16322249.
- ↑ Y. Kang, P. M. Siegel, W. Shu, M. Drobnjak, S. M. Kakonen, C. Cordón-Cardo, T. A. Guise, J. Massagué: A multigenic program mediating breast cancer metastasis to bone. In: Cancer cell Band 3, Nummer 6, Juni 2003, S. 537–549, ISSN 1535-6108. PMID 12842083.
- ↑ J. J. Yin, K. Selander, J. M. Chirgwin, M. Dallas, B. G. Grubbs, R. Wieser, J. Massagué, G. R. Mundy, T. A. Guise: TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. In: The Journal of clinical investigation Band 103, Nummer 2, Januar 1999, S. 197–206, ISSN 0021-9738. doi:10.1172/JCI3523. PMID 9916131. PMC 407876.
- ↑ M. Deckers, M. van Dinther, J. Buijs, I. Que, C. Löwik, G. van der Pluijm, P. ten Dijke: The tumor suppressor Smad4 is required for transforming growth factor beta-induced epithelial to mesenchymal transition and bone metastasis of breast cancer cells. In: Cancer research Band 66, Nummer 4, Februar 2006, S. 2202–2209, ISSN 0008-5472. doi:10.1158/0008-5472.CAN-05-3560. PMID 16489022.
- ↑ Y. Kang, W. He, S. Tulley, G. P. Gupta, I. Serganova, C. R. Chen, K. Manova-Todorova, R. Blasberg, W. L. Gerald, J. Massagué: Breast cancer bone metastasis mediated by the Smad tumor suppressor pathway. In: Proceedings of the National Academy of Sciences of the United States of America Band 102, Nummer 39, September 2005, S. 13909–13914, ISSN 0027-8424. doi:10.1073/pnas.0506517102. PMID 16172383. PMC 1236573.
- ↑ D. Javelaud, K. S. Mohammad, C. R. McKenna, P. Fournier, F. Luciani, M. Niewolna, J. André, V. Delmas, L. Larue, T. A. Guise, A. Mauviel: Stable overexpression of Smad7 in human melanoma cells impairs bone metastasis. In: Cancer research Band 67, Nummer 5, März 2007, S. 2317–2324, ISSN 0008-5472. doi:10.1158/0008-5472.CAN-06-3950. PMID 17332363.
- ↑ R. Ge, V. Rajeev, P. Ray, E. Lattime, S. Rittling, S. Medicherla, A. Protter, A. Murphy, J. Chakravarty, S. Dugar, G. Schreiner, N. Barnard, M. Reiss: Inhibition of growth and metastasis of mouse mammary carcinoma by selective inhibitor of transforming growth factor-beta type I receptor kinase in vivo. In: Clinical cancer research Band 12, Nummer 14 Pt 1, Juli 2006, S. 4315–4330, ISSN 1078-0432. doi:10.1158/1078-0432.CCR-06-0162. PMID 16857807.
- ↑ A. Bandyopadhyay, J. K. Agyin, L. Wang, Y. Tang, X. Lei, B. M. Story, J. E. Cornell, B. H. Pollock, G. R. Mundy, L. Z. Sun: Inhibition of pulmonary and skeletal metastasis by a transforming growth factor-beta type I receptor kinase inhibitor. In: Cancer research Band 66, Nummer 13, Juli 2006, S. 6714–6721, ISSN 0008-5472. doi:10.1158/0008-5472.CAN-05-3565. PMID 16818646.
- ↑ Y. A. Yang, O. Dukhanina, B. Tang, M. Mamura, J. J. Letterio, J. MacGregor, S. C. Patel, S. Khozin, Z. Y. Liu, J. Green, M. R. Anver, G. Merlino, L. M. Wakefield: Lifetime exposure to a soluble TGF-beta antagonist protects mice against metastasis without adverse side effects. In: The Journal of clinical investigation Band 109, Nummer 12, Juni 2002, S. 1607–1615, ISSN 0021-9738. doi:10.1172/JCI15333. PMID 12070308. PMC 151015.
- ↑ R. S. Muraoka, N. Dumont, C. A. Ritter, T. C. Dugger, D. M. Brantley, J. Chen, E. Easterly, L. R. Roebuck, S. Ryan, P. J. Gotwals, V. Koteliansky, C. L. Arteaga: Blockade of TGF-beta inhibits mammary tumor cell viability, migration, and metastases. In: The Journal of clinical investigation Band 109, Nummer 12, Juni 2002, S. 1551–1559, ISSN 0021-9738. doi:10.1172/JCI15234. PMID 12070302. PMC 151012.
- ↑ T. Hayashi, T. Hideshima, A. N. Nguyen, O. Munoz, K. Podar, M. Hamasaki, K. Ishitsuka, H. Yasui, P. Richardson, S. Chakravarty, A. Murphy, D. Chauhan, L. S. Higgins, K. C. Anderson: Transforming growth factor beta receptor I kinase inhibitor down-regulates cytokine secretion and multiple myeloma cell growth in the bone marrow microenvironment. In: Clinical cancer research Band 10, Nummer 22, November 2004, S. 7540–7546, ISSN 1078-0432. doi:10.1158/1078-0432.CCR-04-0632. PMID 15569984.
Wikimedia Foundation.