- Positronen-Emissions-Tomographie bei Knochenmetastasen
-
Die Positronen-Emissions-Tomografie bei Knochenmetastasen ist ein diagnostisches Verfahren zum Nachweis und zur Beurteilung von Knochenmetastasen.
Inhaltsverzeichnis
Darstellung mittels FDG
Die Positronen-Emissions-Tomografie (PET) mit 18F-2-Fluor-2-deoxy-D-glucose (FDG) als Radiotracer – das „Arbeitspferd“ in der onkologischen PET[1] – ist bei vielen Tumorarten ein sehr effizientes Verfahren zu Bestimmung der Metastasierung und für die Nachsorgeuntersuchung (Rezidivdiagnostik). FDG ist ein Glucose-Derivat. Nach intravenöser Verabreichung wird es von allen Zellen mit einem erhöhten Stoffwechsel bevorzugt aufgenommen. Tumorzellen haben in der Regel aufgrund ihres gegenüber gesunden Zellen gesteigerten Stoffwechsels auch einen erhöhten Bedarf an Glucose. Diese Zellen reichern FDG an, da es wegen seiner Modifikation im Gegensatz zur Glucose nicht metabolisiert werden kann. Beim Zerfall des radioaktiven Fluor-18 (18F)entsteht ein Positron, das nach kurzer Zeit mit einem Elektron der näheren Umgebung in zwei hochenergetische Photonen zerstrahlt wird. Die Photonen werden über das PET detektiert und über die Summe der Ereignisse zu Schnittbildern berechnet. Aus dem 18F wird bei dem Zerfall 18O, wodurch aus dem FDG normale Glucose entsteht, die metabolisiert werden kann.
Darstellung mittels NaF
An Stelle von FDG eignet sich zur Darstellung von Knochenmetastasen der Radiotracer des Fluorid-Ions 18F−, der in vielen Fällen der FDG-PET überlegen ist. Man spricht dann von einer 18F-PET, beziehungsweise, da als Gegenion üblicherweise Natrium verwendet wird, von einer 18F-NaF-PET. Die Fluorid-Ionen gehen nach intravenöser Verabreichung sehr schnell per Diffusion in die extrazelluläre Flüssigkeit der Knochen, wo sie langsam mittels Anionenaustausch aus dem dort vorhandenen Hydroxylapatit Fluorapatit bilden. Dieser Vorgang findet bevorzugt in den Bereichen statt, bei denen ein intensiver Knochenumbau im Gang ist, beispielsweise Knochenmetastasen oder Frakturen.
In einer Studie konnten mit der 18F-PET im Vergleich zur konventionellen Skelettszintigrafie doppelt so viele Knochenmetastasen nachgewiesen werden. Die Spezifität ist ebenfalls deutlich höher.[2]
Die Fluorid-18-PET ist deshalb derzeit die genaueste und empfindlichste Methode zur Bestimmung von Knochenmetastasen.[3]
Für die Skelettszintigrafie wurde 18F-NaF bereits in den 1960er Jahren verwendet und erstmals 1962 beschrieben.[4] In den 1970er Jahren wurde es dann durch die 99mTechnetium-markierten Bisphosphonate weitgehend verdrängt,[5] die für die in der Szintigrafie verwendeten Gammakameras besser geeignet sind. Mit der Verbreitung der Positronen-Emissions-Tomografie und vor allem aufgrund einer seit dem Jahr 2008 anhaltenden Verknappung von Molybdän-99,[6] dem Ausgangsmaterial für Technetium-99m-Generatoren, erlebt dieser Radiotracer eine Art Renaissance, mit dem Potenzial die konventionelle Szintigrafie mit 99mTc und Gammakamera zu ersetzen.[7][8][9] Fluor-18 kann in einem Zyklotron erzeugt werden, während 99Mo in einem Kernreaktor mit hohem Neutronenfluss produziert werden muss.
Die beiden Radiotracer FDG und 18F-NaF können auch simultan verabreicht und mit einem Scan detektiert werden, wodurch die Vorteile beider Tracer miteinander vereinigt werden.[10] Noch vorteilhafter ist die kombinierte Anwendung in einem PET/CT.[11]
Knochenmetastasen des Prostatakarzinoms
Bei Knochenmetastasen einiger Tumorentitäten, speziell des Primärtumors Prostatakarzinom, ist die FDG-PET in vielen Fällen ungeeignet.[12] Die Aufnahme von FDG ist bei den Zellen der langsam wachsenden Skelettmetastasen des Prostatakarzinoms bei einem großen Teil der Patienten zu gering. In einer Studie konnten beispielsweise nur 65 % der skelettszintigrafisch nachgewiesenen Metastasen per FDG-PET erkannt werden.[13] Andere Studien kommen zu noch schlechteren Werten.[14] Daher kommen zur Darstellung des Prostatakarzinoms die Radiotracer 18F-Fluorethylcholin und 18F-Cholin zum Einsatz. Die Aufnahme von Cholin ist bei diesen Tumorzellen höher als die von Glucose. Cholin ist ein für alle Zellen wichtiger Baustein zum Aufbau der Phosphatidylcholine, einer Gruppe von Zellmembran-bildenden Phospholipiden. Prostatakrebszellen nehmen im Vergleich zu normalen Zellen vermehrt Cholin beziehungsweise die 18F-markierten Cholin-Derivate auf, weshalb sich diese – mit dem natürlichen Cholin verwandten – Radiotracer dort anreichern. Dies ist nicht nur bei den Zellen des Primärtumors des Prostatakarzinoms, sondern auch bei allen seinen Metastasen der Fall.
Statt des 18F-Fluorethylcholin wird vereinzelt auch das mit dem natürlichen Cholin chemisch identische 11C-Cholin verwendet. Allerdings ist dessen Handhabung wegen der sehr kurzen Halbwertszeit von 20 Minuten (im Vergleich dazu knapp zwei Stunden bei 18F) deutlich schwieriger.[15]
- F-18-Cholin-PET/CT
-
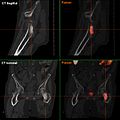
Osteolytische Knochenmetastase im zweiten Halswirbelknochen (Axis) eines metastasierten Prostatakarzinoms
-
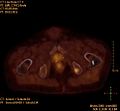
CT einer Prostatakrebs-Metastase im linken Schambein (im Bild rechts)
- Videos
-
Maximumintensitätsprojektion (MIP) einer PET/CT mit Cholin. Die physiologische Anreicherung in Leber, Pankreas, Nieren, Blase, Milz, Knochenmark und den Speicheldrüsen ist deutlich zu erkennen. Die Knochenmetastase befindet sich im Schambein links.
-
PET/CT in MIP mit 18Fluor-Desoxyglucose (FDG) bei metastasierendem Brustkrebs. Primärtumor in der rechten Brust. Lymphknotenmetastasen im Mediastinum und Lungenmetastasen. Die Knochenmetastasen lassen sich in der Untersuchung mit 18F-NaF (nächstes Video) besser abgrenzen.
-
PET/CT in MIP mit 18F-Natriumfluorid (NaF) bei metastasierendem Brustkrebs. Knochenmetastasen in Schädel, Wirbelsäule, Becken, Rippen, linkem Schlüsselbein und rechtem Oberschenkel. Die gleiche Patientin wie in dem FDG-Video
Literatur
- D. Hellwig, B.-J. Krause, H. Schirrmeister, M. Freesmeier: Skelettdiagnostik mittels 18F-Natriumfluorid-PET und PET/CT. DGN-Leitlinie, Version 1.0 Nuklearmedizin 2010; 49: 195–201 doi:10.3413/nukmed-0343
- B. J. Krause, U. Treiber, S. Schwarzenböck, M. Savatzoglou: Cholin-PET/CT zur Bildgebung des Prostata-Karzinoms. Der Nuklearmediziner 2010; 33: 181–186 doi:10.1055/s-0030-1254161
Einzelnachweise
- ↑ A. K. Shukla, U. Kumar: Positron emission tomography: An overview. In: Journal of medical physics / Association of Medical Physicists of India. Band 31, Nummer 1, ISSN 0971-6203, Januar 2006, S. 13–21. doi:10.4103/0971-6203.25665, PMID 21206635, PMC 3003889.
- ↑ J. Kotzerke, S. N. Reske: PET-Bildgebung (C-11-Azetat). Universitätsklinikum Ulm
- ↑ H. Schirrmeister, A. Guhlmann, J. Kotzerke, C. Santjohanser, T. Kühn, R. Kreienberg, P. Messer, K. Nüssle, K. Elsner, G. Glatting, H. Träger, B. Neumaier, C. Diederichs, S. N. Reske: Early detection and accurate description of extent of metastatic bone disease in breast cancer with fluoride ion and positron emission tomography. In: Journal of clinical oncology Band 17, Nummer 8, ISSN 0732-183X, August 1999, S. 2381–2389, PMID 10561300.
- ↑ M. Blau, W. Nagler, M. A. Bender: Fluorine-18: a new isotope for bone scanning. In: Journal of nuclear medicine Band 3, ISSN 0161-5505, Juli 1962, S. 332–334, PMID 13869926.
- ↑ G. Subramanian, J. G. McAfee: A new complex of 99mTc for skeletal imaging. In: Radiology Band 99, Nummer 1, ISSN 0033-8419, April 1971, S. 192–196, PMID 5548678.
- ↑ H. Kaulen: Mangel an medizinisch verwendbaren Isotopen. In: faz.net vom 9. Februar 2009.
- ↑ J. Czernin, N. Satyamurthy, C. Schiepers: Molecular mechanisms of bone 18F-NaF deposition. In: Journal of nuclear medicine. Band 51, Nummer 12, Dezember 2010, S. 1826–1829, ISSN 1535-5667. doi:10.2967/jnumed.110.077933, PMID 21078790 (Review).
- ↑ W. Langsteger, M. Heinisch, I. Fogelman: The role of fluorodeoxyglucose, 18F-dihydroxyphenylalanine, 18F-choline, and 18F-fluoride in bone imaging with emphasis on prostate and breast. In: Seminars in nuclear medicine. Band 36, Nummer 1, ISSN 0001-2998, Januar 2006, S. 73–92doi:10.1053/j.semnuclmed.2005.09.002, PMID 16356797 (Review).
- ↑ F. D. Grant, F. H. Fahey, A. B. Packard, R. T. Davis, A. Alavi, S. T. Treves: Skeletal PET with 18F-fluoride: applying new technology to an old tracer. In: Journal of nuclear medicine. Band 49, Nummer 1, ISSN 0161-5505, Januar 2008, S. 68–78, doi:10.2967/jnumed.106.037200, PMID 18077529 (Review).
- ↑ S. Hoegerle, F. Juengling, A. Otte, C. Altehoefer, E. A. Moser, E. U. Nitzsche: Combined FDG and [F-18]fluoride whole-body PET: a feasible two-in-one approach to cancer imaging? In: Radiology. Band 209, Nummer 1, ISSN 0033-8419, Oktober 1998, S. 253–258, PMID 9769840.
- ↑ A. Iagaru, E. Mittra, S. S. Yaghoubi, D. W. Dick, A. Quon, M. L. Goris, S. S. Gambhir: Novel strategy for a cocktail 18F-fluoride and 18F-FDG PET/CT scan for evaluation of malignancy: results of the pilot-phase study. In: Journal of nuclear medicine Band 50, Nummer 4, ISSN 0161-5505, April 2009, S. 501–505, doi:10.2967/jnumed.108.058339, PMID 19289439.
- ↑ C. Hofer, C. Laubenbacher, T. Block, J. Breul, R. Hartung, M. Schwaiger: Fluorine-18-fluorodeoxyglucose positron emission tomography is useless for the detection of local recurrence after radical prostatectomy. In: European urology. Band 36, Nummer 1, ISSN 0302-2838, 1999, S. 31–35, PMID 10364652.
- ↑ P. D. Shreve, H. B. Grossman, M. D. Gross, R. L. Wahl: Metastatic prostate cancer: initial findings of PET with 2-deoxy-2-[F-18]fluoro-D-glucose. In: Radiology. Band 199, Nummer 3, ISSN 0033-8419, Juni 1996, S. 751–756, PMID 8638000.
- ↑ S. D. Yeh, M. Imbriaco, S. M. Larson, D. Garza, J. J. Zhang, H. Kalaigian, R. D. Finn, D. Reddy, S. M. Horowitz, S. J. Goldsmith, H. I. Scher: Detection of bony metastases of androgen-independent prostate cancer by PET-FDG. In: Nuclear medicine and biology. Band 23, Nummer 6, ISSN 0969-8051, August 1996, S. 693–697, PMID 8940712.
- ↑ The MICAD Research Team: 18F-Fluorocholine. In: Molecular Imaging and Contrast Agent Database (MICAD) PMID 20641761 (Stand 1. Februar 2011)

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Diagnostisches Verfahren in der Nuklearmedizin
- Tomografie
Wikimedia Foundation.