- Phosphotransferasesystem
-
Das Phosphotransferasesystem (PTS), genauer Phosphoenolpyruvat-Phosphotransferasesystem (PEP-PTS) ist ein aktives Stofftransportsystem von Mikroorganismen, das über Gruppentranslokation arbeitet. Bislang wurde es nur bei Bakterien nachgewiesen.[1]
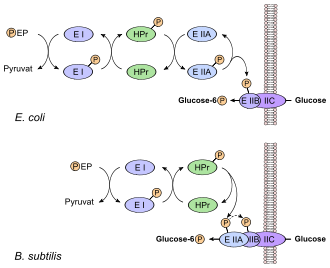
Hierbei wird der hochenergetische Phosphatrest von Phosphoenolpyruvat (PEP) über mehrere Proteinkinasen (Signaltransduktion) zunächst auf die Transportproteine und schließlich auf das Substrat, meist Hexosen (Glucose, Mannose, Fructose) oder Zuckeralkohole (z. B. Glucitol, Mannitol) übertragen. Das Substrat kann nun durch die Membranproteine ins Cytoplasma eingeschleust werden, wo es dann phosphoryliert vorliegt. Aus PEP entsteht dabei Pyruvat.
Der erste Reaktionsschritt besteht hierbei aus der Übertragung des Phosphatrests auf das unspezifische Enzym I (EI), welches anschließend ein Histidin-haltiges Protein (HPr) an seinem Histidinrest phosphoryliert. Erst die nun folgenden Übertragungsschritte auf den Enzymkomplex Enzym II (EII) sind substratspezifisch. Dieser ist aus mindestens drei Domänen (A bis C) aufgebaut, welche systemabhängig zu einem Komplex fusionieren oder separat im Cytoplasma der Zelle vorliegen können. Das eigentliche Transportprotein ist hierbei das Enzym II C, welches in die Membran integriert ist. Enzym IIB ist die einzige Komponente dieses Systems, die an einem Cysteinrest phosphoryliert wird; alle anderen Komponenten erfahren eine Übertragung auf einen Histidinrest.
Das PTS ist ebenfalls an der Regulation der Stoffwechselwege beteiligt. Da viele chemoheterotrophe Bakterien Glucose als bevorzugte Kohlenstoffquelle nutzen, werden bei deren Verfügbarkeit Stoffwechselwege zur Verwertung anderer Zucker auf Transkriptionsebene abgeschaltet (Katabolitrepression). Das E IIA-Protein für den Glucosetransport aus Escherichia coli aktiviert in seiner phosphorylierten Form die Adenylatcyclase, welche cAMP synthetisiert. cAMP wirkt mit seinem Rezeptorprotein CRP als Transkriptionsaktivator für die Expression von Genen deren Produkte die Aufnahme alternativer Kohlenstoffquellen ermöglichen.
In seiner dephosphorylierten Form inhibiert E IIA zudem Transporter für die Aufnahme anderer Zucker.
Literatur
- Deutscher, J., Francke, C. und Postma, PW. (2006): How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria. In: Microbiol Mol Biol Rev. 70(4); 939–1031; PMID 17158705; PDF (freier Volltextzugriff, engl.)
- Siebold, C., Flükiger, K., Beutler, R. und Erni, B. (2001): Carbohydrate transporters of the bacterial phosphoenolpyruvate: sugar phosphotransferase system (PTS). In: FEBS Lett. 504(3); 104–111; PMID 11532441; PDF (freier Volltextzugriff, engl.)
Einzelnachweise
- ↑ 4.A: Phosphotransfer-driven group translocators. In: TCDB. Saier Lab Bioinformatics, abgerufen am 16. September 2010 (englisch).
Wikimedia Foundation.