- Prostata-Krebs
-
Klassifikation nach ICD-10 C61 Bösartige Neubildung der Prostata ICD-10 online (WHO-Version 2006) Der Prostatakrebs (medizinisch: Prostatakarzinom; PCa), eine bösartige Tumorerkrankung, geht vom Drüsengewebe der Vorsteherdrüse (Prostata) aus. In Deutschland sterben knapp 3 von 100 Männern an Prostatakrebs.[1][2] Auch wenn der Wert relativ gering ist, gehört der Prostatakrebs zu den häufigsten Krebserkrankungen des Mannes: Er ist innerhalb der Gruppe der an Krebs gestorbenen Männer für etwa zehn Prozent der Todesfälle verantwortlich und stellt damit die dritthäufigste tödliche Krebserkrankung nach Lungen- und Darmkrebs dar.[2]
Die Erkrankung ist im Frühstadium symptomlos. Im fortgeschrittenen Stadium können Beschwerden wie Blasenentleerungsstörungen, Knochenschmerzen und später Gewichtsverlust und Blutarmut auftreten. Wird die Diagnose erst gestellt, wenn bereits Symptome aufgetreten sind, hat häufig schon eine Metastasierung stattgefunden, vorrangig in die lokalen Lymphknoten oder in das Skelett.
Eine Behandlung mit Aussicht auf Heilung ist nur möglich, wenn das entartete Gewebe die Organgrenzen noch nicht überschritten hat und keine Metastasen vorliegen. Da es in der Regel erst bei fortgeschrittener Erkrankung zu Beschwerden kommt, wird in Deutschland eine regelmäßige Früherkennungsuntersuchung für Männer über 45 Jahren angeboten, um die Krebsdiagnose möglichst früh in einem noch heilbaren Stadium zu stellen. Das Prostatakarzinom ist jedoch eine Krankheit älterer Männer, und die Mehrzahl der Erkrankten würde an anderen Ursachen versterben, bevor es überhaupt Symptome verursacht. So hat sich in den Jahren nach der Jahrtausendwende Aktives Beobachten als brauchbares Konzept für Männer entwickelt, die sich (zumindest zunächst) keiner invasiven Therapie unterziehen möchten. Die Entscheidung zur Behandlung ist jedoch schwierig und vom Einzelfall abhängig. Therapeutische Optionen sind die Operation mit kompletter Entfernung der Prostata (Prostatektomie), die Strahlentherapie, die Hormontherapie und in manchen Fällen die Chemotherapie. In der Erprobungsphase befindet sich noch die therapeutische Hyperthermie („Nanotherapie“).
Prostatakrebs ist auch bei Tieren beschrieben, unter den Haustieren ist er beim Haushund am häufigsten.
Die Prostata
- Hauptartikel: Prostata
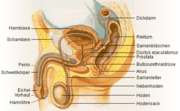
Die Prostata oder Vorsteherdrüse ist eine akzessorische Geschlechtsdrüse aller männlichen Säugetiere einschließlich des Menschen. Sie liegt beim Menschen unterhalb der Harnblase und umkleidet die Harnröhre bis zum Beckenboden. Sie ähnelt beim Mann in Größe und Form einer Kastanie. An die Rückseite der Prostata grenzt der Mastdarm (Rektum). Deswegen kann sie vom Enddarm aus mit den Fingern ertastet und beurteilt werden. Aufgabe der Prostata ist die Abgabe eines Sekrets, das zusammen mit dem der Samenblase, der Bulbourethraldrüse und den aus dem Hoden stammenden Samenzellen das Sperma bildet. Wachstum und Funktion der Vorsteherdrüse werden vorwiegend von dem Geschlechtshormon Testosteron gesteuert.
Epidemiologie
Das Prostatakarzinom ist in Deutschland die häufigste diagnostizierte Krebserkrankung des Mannes und steht nach dem Bronchialkarzinom und dem kolorektalen Karzinom an dritter Stelle bei den krebsbedingten Todesursachen der Männer. Rund 22 Prozent aller bei Männern jährlich neu auftretenden Krebserkrankungen betreffen die Prostata. Das entspricht einer altersstandardisierten Inzidenzrate von nahezu 100 auf 100.000 männliche Personen beziehungsweise deutlich mehr als 40.000 neu diagnostizierten Prostatakarzinomen pro Jahr im Bundesgebiet.[3] Die beobachtbare, vermeintlich starke Zunahme in den letzten Jahrzehnten ist eher auf verbesserte diagnostische Methoden und eine allgemein höhere Lebenserwartung zurückzuführen als auf eine tatsächliche Zunahme der Fallzahlen.
Jahr 1980 1985 1990 1995 2000 Jährliche Neuerkrankungen
in Deutschland (geschätzt)[3]16.800 21.600 27.500 35.400 44.800 Die jährliche Mortalität (Gesamtzahl der Todesfälle) liegt um 11.000.[4] Bei Männern unter 40 ist das Prostatakarzinom praktisch unbekannt. Die jährliche Prävalenz steigt mit zunehmendem Lebensalter deutlich an, zwischen dem 40. und dem 80. Lebensjahr um mehr als den Faktor 1.000. Durch Obduktionen weiß man, dass bis zu 80 % der über 70-Jährigen ein latentes Prostatakarzinom haben, ohne daran verstorben zu sein.[5][6] Das mittlere Alter bei Diagnosestellung beträgt 71 Jahre.
Es gibt starke geographische und ethnische Unterschiede in der Häufigkeit: Schwarze US-Amerikaner haben die höchste Inzidenzrate, am niedrigsten ist sie bei Asiaten.[7][8]
Die Daten für die weltweiten Erkrankungsraten sind nicht zuverlässig, da sie zum Teil auf Schätzungen beruhen und die diagnostischen Möglichkeiten in den einzelnen Regionen sehr differieren. Die auf Daten der Internationalen Agentur für Krebsforschung (IARC) beruhende Erhebung GLOBOCAN gibt für das Jahr 2002 insgesamt knapp 680.000 Neuerkrankungen und etwa 220.000 Todesfälle an. Hiernach ist die jährliche Inzidenzrate in Zentralasien mit weniger als 3/100.000 Einwohner am niedrigsten, die höchste ist auf dem nordamerikanischen Kontinent mit über 160/100.000 Einwohner zu verzeichnen.[9]
Risikofaktoren und protektive Faktoren
Die Ursache der Erkrankung ist bisher weitgehend unbekannt. Die genetische Disposition spielt bei der Entstehung der Erkrankung eine Rolle (familiäre Häufung). Daher gelten Männer, deren Vater oder Bruder Prostatakrebs hatte, als Risikopatienten mit etwa doppeltem Erkrankungsrisiko.[10] Diese Männer sollten die üblicherweise erst ab dem fünfzigsten Lebensjahr erforderliche Krebsfrüherkennung durch Kontrolle des prostataspezifischen Antigens bereits ab dem 45. Lebensjahr wahrnehmen. Die großen Unterschiede in der Krankheitshäufigkeit bei verschiedenen Ethnien werden auch auf deren Lebensgewohnheiten zurückgeführt, zumal die Nachkommen von Emigranten nicht das Erkrankungsrisiko ihrer Vorfahren tragen, sondern das des neuen Heimatlandes annehmen. Eine gewisse Rolle wird hierbei der Ernährung zugeschrieben. Es konnten keine Hinweise darauf gefunden werden, dass die Sterilisation (Vasektomie) das Erkrankungsrisiko erhöht.[11]
Ein sicherer Einflussfaktor ist der Testosteronspiegel, da die Tumorzellen auf die Stimulation durch Androgene angewiesen sind: Eunuchen entwickeln kein Prostatakarzinom. Im Gegensatz dazu stellen die im fortgeschrittenen Lebensalter häufige gutartige Vergrößerung der Prostata (benigne Prostatahyperplasie) und die Prostataentzündung, ob chronisch oder akut, keine unabhängigen Risikofaktoren dar. Noch widersprüchlich ist die aktuelle Datenlage zur eventuellen Krebsförderung durch erhöhte Spiegel des Gewebshormons IGF-1 (insulinähnlicher Wachstumsfaktor).[8]
Nach einer 2003 veröffentlichten Studie[12] soll häufiges Ejakulieren in jüngeren Jahren das Erkrankungsrisiko senken. Australische Wissenschaftler verglichen Daten zu Sexualpraktiken von 1079 Prostatakrebs-Patienten mit denen von 1259 gesunden Männern im Alter zwischen 20 und 50 Jahren. Ihr Ergebnis: Zwanzigjährige, die öfter als fünfmal pro Woche ejakulieren, senken ihr Risiko für den Prostatakrebs um ein Drittel. Methodisch ist hierbei das Ursache-Wirkungs-Verhältnis nicht geklärt. Es könnte durchaus sein, dass Männer mit einem gesunden, leistungsfähigen Genitaltrakt öfter ejakulieren und die Gesundheit der Genitalien die eigentliche Ursache ist, weshalb sie später auch nicht so häufig erkranken.
Im Gegensatz dazu hatten frühere Studien häufige Sexualkontakte mit einem deutlich erhöhten Risiko für Prostatakrebs in Zusammenhang gebracht. Dies könnte jedoch, nach Ansicht der australischen Forscher, durch die höhere Infektionsgefahr bedingt sein. Betrachte man die Zahl der Ejakulationen insgesamt, so hätten diese einen schützenden Effekt, weil durch die häufige Bildung von Samenflüssigkeit krebserregende Substanzen aus der Prostata herausgeschwemmt werden. Auch würden die Prostatazellen auf diese Art zum Ausreifen angeregt, was sie für Karzinogene weniger anfällig machen könnte.
Ein weiterer möglicher Risikofaktor könnte Sonnenmangel sein. Forscher in Nordamerika und in Europa bemerkten ein auffälliges Nord-Süd-Gefälle, das sie sich nur durch die unterschiedliche Besonnung der Menschen erklären konnten. Diesen Zusammenhang fanden die Wissenschaftler für Brustkrebs, Prostatakrebs, Dickdarmkrebs, Ovarialkrebs und offenbar auch für das Melanom und den Blasenkrebs.[13] Eine Schlüsselrolle spielt hierbei anscheinend das Vitamin D. 90 % des vom Körper benötigten Vitamin D werden durch UV-B-Bestrahlung in der Haut gebildet. Erwachsene mit Calcidiol-Spiegeln über 20 µg/ml (im Blutserum) haben zum Beispiel ein dreifach reduziertes Risiko, an Dickdarmkrebs zu erkranken. Welche Blutspiegel von Calcidiol optimal sind, ist allerdings noch unklar.[13] 25-OH-D3 ist ein Leber-Metabolit vom Vitamin D3. Diese Theorie ist mit Vorbehalt zu sehen, denn auf der anderen Seite ist wissenschaftlich bewiesen, dass zu viel „Besonnung“ ein Risikofaktor für das Spinaliom sein kann.
Einige Studien bringen den Konsum von Calcium und Lebensmitteln mit hohem Calciumgehalt (wie Milch und Käse) mit einem erhöhten Risiko für Prostatakrebs in Verbindung. Die vermutete Mechanismus ist wiederum ein erniedrigter Spiegel an Vitamin D3 infolge der erhöhten Calciumzufuhr. Andere Studien zeigten keine Korrelation oder nur eine Korrelation bei sehr hoher Zufuhr von Calcium. Unklar bleibt außerdem, welchen Beitrag das Fett in den Milchprodukten zu dem erhöhten Risiko leistet.[14]
Molekularbiologische Aspekte des Prostatakarzinoms
Wie alle Neoplasien liegt auch dem Prostatakarzinom letztlich die irreversible Veränderung des Erbgutes einer einzigen Zelle zugrunde. Alle Krebszellen sind Abkömmlinge (Klone) dieser Zelle. Verkomplizierend kommt hinzu, dass sich deren Erbgut weiter verändert, da die physiologischen Vorgänge, die DNA-Schäden reparieren oder mutierte normale Körperzellen absterben lassen würden (Apoptose), in Krebszellen nicht zum Tragen kommen. Mit der Zeit entwickelt sich daher ein Mosaik aus Zellen mit unterschiedlich stark verändertem Genom. Klinisch entspricht dem ein inhomogenes Erscheinungsbild des Tumors und ein zunehmendes „Bösartigerwerden“ über die Jahre.
Anders als viele andere epitheliale Malignome hat das Prostatakarzinom keine typische Adenom-Karzinom-Sequenz und auch kein spezifisches Mutationsmuster. Stattdessen kommen sehr heterogene genomische Veränderungen in Form von Punktmutationen an verschiedenen Stellen, Verlusten von Allelen oder ganzen Chromosomen und bisweilen zusätzlich Polyploidie vor. Häufig sind jedoch in einem späteren (metastasierten) Stadium zumindest auch klassische Tumorsuppressorgene wie TP53 von Deletionen oder Mutationen betroffen. Eine wichtige Rolle scheinen Veränderungen des den Androgenrezeptor codierenden Gens zu spielen. Derzeit sind mindestens 17 genetisch verschiedene Zelllinien des Prostatakarzinoms bekannt.[15]
Pathologie und Histopathologie
Makroskopische Pathologie
Makroskopisch-pathologisch erscheint das Karzinom meist tiefgelb und homogen. Mehrheitlich geht es von den Epithelien der peripheren Drüsenanteile aus, zu etwa 85 % in den hinteren (rektalen) Anteilen der Vorsteherdrüse, und breitet sich in den äußeren Zonen des Organs aus. Zur Verlegung der Harnröhre mit Beschwerden des Harnlassens kommt es daher erst spät, meist nachdem die Organkapsel schon durchbrochen wurde.
Ausgedehnte Karzinome der Stadien T3/T4 können die Samenblasen, die Harnblase, den Beckenboden oder das Rektum infiltrieren. Die Metastasierung ist zunächst lymphogen (über die Lymphbahnen). Typisch sind Knochenmetastasen in Becken, Kreuzbein und Lendenwirbelsäule, Oberschenkelknochen, Brustwirbelsäule und Rippen. Diese sind fast immer osteoblastisch (knochenbildend). Fernmetastasen in Lunge und Leber durch hämatogene Aussaat (über den Blutkreislauf) sind seltener. [16]
Mikroskopische Pathologie
97 % aller Prostatatumoren sind Adenokarzinome, das heißt, sie entstehen aus entarteten Drüsenzellen. Ein Übergangsstadium zum manifesten Krebs wird als prostatische intraephitheliale Neoplasie (PIN) bezeichnet und entspricht einem Carcinoma in situ. Beim eigentlichen Karzinom kommen verschiedene histopathologische Wachstumsmuster vor, auch gleichzeitig nebeneinander: glandulär beziehungsweise azinär (drüsenartig), kribriform (siebartig) und solide. Das Ausmaß der Entdifferenzierung ist Grundlage des Gradings. 40-50 % der Tumoren liegen bei Diagnosestellung multifokal vor. [17]
Die Nicht-Adenokarzinome (weniger als 3 %) sind meist urothelialer Herkunft, leiten sich also aus dem Übergangsgewebe der Harnröhre oder -blase ab (siehe Blasenkrebs). Äußerst selten sind Sarkome (Leiomyosarkom, Fibrosarkom, Rhabdomyosarkom) des Stromas beim Erwachsenen. Bei Kindern sind Rhabdomyosarkome die häufigste Form des Prostatakrebses, werden aber nicht wie bei erwachsenen Patienten als Prostatakarzinom aufgefasst, sondern als Weichteilsarkom.[18][19]
Symptomatik
In frühen Stadien ist Prostatakrebs nahezu immer symptomlos. Hauptbeschwerden ergeben sich beim fortgeschrittenen Karzinom aus der Blockade des Harnabflusses und bestehen somit in Störungen der Miktion. Möglich sind ein verzögerter Beginn, eine verlängerte Miktion mit schwachem Strahl, Nachtropfen oder die Unterbrechung des Harnstrahls während des Wasserlassens. Oft bleibt Restharn in der Blase zurück. Irritative Beschwerden sind vermehrter oder überwiegend nächtlich auftretender Harndrang (Nykturie), häufiges Lassen geringer Urinmengen (Pollakisurie) erschwertes Wasserlassen (Dysurie) oder Schmerzen beim Wasserlassen (Algurie). Durch Druckschädigung von Nerven des Kreuzbeinbereichs kann es zu Erektionsstörungen kommen. Sichtbares Blut im Urin (Hämaturie) oder Ejakulat (Hämatospermie) ist hingegen selten.
Beschwerden können im fortgeschrittenen Stadium mit Metastasierung auch primär durch die Metastasen entstehen, während das Prostatakarzinom klinisch stumm bleibt (Okkultes Karzinom). Am häufigsten sind hier Schmerzen der Wirbelsäule und des Beckens. Bei starker metastatischer Durchsetzung kann es zu spontanen Knochenbrüchen ohne Trauma, sogenannten pathologischen Frakturen, kommen. Da häufig die Wirbelsäule die erste Aussaatstrecke bildet, sind komplexe neurologische Ausfälle durch Rückenmarksverletzung wie Querschnittsyndrome oder das Cauda-equina-Syndrom nicht selten. Lymphknotenmetastasen können zu Lymphödemen der Beine oder des Skrotums führen.
Fortgeschritten metastasierte Tumoren führen auch zu Allgemeinsymptomen wie Anämie und ungewolltem Gewichtsverlust.
Diagnostik
Mit der digital-rektalen Untersuchung kann ein erfahrener Untersucher bereits die Verdachtsdiagnose stellen, da der Tastbefund typisch ist. Allerdings werden so die selteneren Tumoren der vorderen Organregionen unter Umständen übersehen und allgemein erst recht fortgeschrittene Stadien erkannt.[20] Genauere Lokalisation und Größenbestimmung erlaubt die Ultraschalluntersuchung (transrektale Sonografie). Tumore ab 10 mm Durchmesser können damit zuverlässig gefunden werden, kleinere jedoch nur zu etwa 20 %.[17] Die Magnetresonanztomographie hat sich dem transrektalen Ultraschall als etwa gleichwertig erwiesen, ist jedoch wesentlich aufwändiger und kostenintensiver in der Durchführung. Der Primärtumor stellt sich in T2-Wichtung als umschriebene Hypointensität mit relativ hyperintenser Umgebungszone dar.[17] Des Weiteren etabliert sich immer mehr die Positronen-Emissions-Tomographie (PET) mit 11C-Cholin (radioaktiv markierter Tracer). Vor allem mittels 11C-Cholin PET/CT kann zuverlässig Prostatakrebs-Gewebe von benigner Hyperplasie, chronischer Prostatitis und gesundem Prostata-Gewebe differenziert werden.[21][22] Zu den Laborparametern gehören die saure Phosphatase (SP) und das prostataspezifische Antigen (PSA). Vor allem das PSA hat momentan einen hohen Stellenwert in der Diagnostik. Es ist spezifisch für die Prostata, allerdings nicht für ein Tumorleiden, sondern kann auch bei Entzündungen, benigner Prostatahyperplasie, einem Harnverhalt oder ohne ersichtlichen Grund erhöht sein. Ein Wert über 4 ng/ml gilt als abklärungsbedürftig. Das PSA ist jedoch der entscheidende Parameter in der Tumornachsorge nach operativer Therapie und nach einer Strahlentherapie. Dieselbe Bedeutung kommt ihm in der Verlaufskontrolle eines antiandrogen (Hormontherapie) behandelten Prostatakarzinoms zu.
Des Weiteren stehen eine Protein-Muster-Diagnostik und der PCA3-Test zur Verfügung, als Material wird Urin verwendet. Beide Verfahren sind nicht etabliert, die Kosten werden in Deutschland üblicherweise von den gesetzlichen Krankenkassen nicht übernommen.
Beweisend für ein Prostatakarzinom ist ausschließlich der Nachweis von Krebszellen in einer bioptisch entnommenen Gewebeprobe. Die Biopsie wird transrektal unter Ultraschallkontrolle durchgeführt. Es werden mit einer Hohlnadel mindestens je drei Gewebeproben aus beiden Seiten des Organs entnommen. Bei einer großen Prostata sollte naturgemäß die Zahl der Biopsien höher liegen. Ein Pathologe begutachtet das Prostatagewebe und stellt seine Diagnose.
Falls sich die Diagnose „Prostatakrebs“ bestätigt, ist eine Stadienbestimmung, das sogenannte Staging, erforderlich. Hier wird festgestellt, ob der Tumor bereits ausgestreut hat oder ob es sich um ein auf die Prostata begrenztes Karzinom handelt.
Zu den erforderlichen Untersuchungen gehört eine Sonografie (Ultraschalluntersuchung) der Organe des Bauchraumes, insbesondere der Leber, Nieren und Lymphknoten sowie eine Röntgenuntersuchung der Lunge. Eine Skelettszintigrafie wird zum Ausschluss von Knochenmetastasen in Abhängigkeit vom PSA-Wert durchgeführt. Zusätzlich können noch eine Computertomographie von Bauch und Lunge sowie eine Ausscheidungsurografie der Nieren mit Kontrastmittel zur Beurteilung des Harnleiterverlaufes und eine Blasenspiegelung erfolgen.
Zur exakten Beurteilung eines organüberschreitenden Wachstums (Stadium T3) bei stanzbioptisch gesichertem Prostatakarzinom hat sich bisher kein bildgebendes Verfahren (CT, MRT mit Endorektalspule, transrektale Ultraschalluntersuchung) etablieren können.
Tumorstadien
Manifestationsstadien
Man unterscheidet nach Mostofi[23] folgende Manifestationsstadien:
Manifestationsstadium Beschreibung Manifestes Karzinom Der Primärtumor verursacht Symptome oder ist klinisch diagnostizierbar (palpabel). Okkultes Karzinom Die Metastasen werden symptomatisch oder klinisch diagnostizierbar, nicht aber der Primärtumor. Inzidentielles Karzinom Zufallsbefund bei der Untersuchung oder Operation unter anderer Fragestellung. Latentes Karzinom Zufälliger Obduktionsbefund bei einem aus anderer Ursache Verstorbenen. Histopathologisches Grading
Bei der mikroskopischen Untersuchung des entnommenen Gewebes werden die biologischen Eigenschaften des Tumors genauer bestimmt und seine Bösartigkeit ermittelt. So beschreibt ein besonderes Einordnungsschema (G: Histopathologisches Grading), wie stark sich die Tumorzellen mikroskopisch von normalen, „ausgereiften“ Zellen unterscheiden.
Histopathologisches Grading Stadium Beschreibung Gx Es kann keine Aussage gemacht werden G1 Hochdifferenziert, noch sehr gewebeähnlich G2 Mäßig differenziert G3 Schlecht differenziert G4 Völlig undifferenziert Gleason-Score
Mittlerweile wird auch in Europa, nicht nur in Großbritannien, Irland und Skandinavien, sondern auch in der Schweiz, in Österreich und den meisten romanischen Ländern aus Gründen der internationalen Vergleichbarkeit fast ausschließlich der „Gleason-Score“ verwendet. Da im Rahmen der Europäischen Gemeinschaft zunehmend einheitliche Beurteilungskriterien für vergleichende epidemiologische oder therapeutische Studien gefordert werden, nicht zuletzt aus Gründen der internationalen Akzeptanz und Vergleichbarkeit von Ergebnissen für wissenschaftliche Publikationen, wird das Gleason-Grading inzwischen auch in Deutschland (neben dem bisher üblichen kombinierten histologisch-zytologischen Grading) bevorzugt verwendet. Dabei wird nach dem histologischen Bild das am häufigsten und das am zweithäufigsten vorkommende Tumorgewebe mit Punktwerten zwischen 1 und 5 (zusammen also zwischen 2 und 10) bewertet.
- Gleason-Score < 7 = günstigere Prognose.
- Gleason-Score > 7 = schlechtere Prognose[24].
Für Patienten kann noch die Information von Bedeutung sein, dass die Gleason-Summe als Indikator für die Bösartigkeit des Tumors zwar zwischen 2 und 10 liegen kann (s.o.). In der Praxis kommen die Gleason-Summen 2, 3 und 4 allerdings als Ergebnis einer Stanzbiopsie nicht vor[25]. Das bedeutet, dass bei einer Diagnose mit Gleason-Summe von 5 oder 6 durchaus auch ein Krebs mit niedrigem Risiko vorliegen kann, obwohl der gemessene Wert auf einen mittelschweren Fall hindeutet. Vor allem in diesen (häufigen) Fällen können zusätzliche Informationen zum Grading (siehe nächster Abschnitt: DNA-Zytometrie) bedeutsam sein.
Ergänzendes Grading mit DNA-Zytometrie
Weil der Gleason-Score ein gewisses subjektives Element enthält (das Zweitgutachten eines Referenzpathologen ergibt häufig unterschiedliche, meist höhere Werte), wird vor allem von Seiten der Prostatakrebs-Selbsthilfegruppen zunehmend empfohlen, die als Biopsie entnommene Probe zusätzlich auf den so genannten Ploidiegrad zu untersuchen. Dieses Verfahren wird DNA-Zytometrie genannt und von einzelnen urologischen Chefärzten an Kliniken [26] wie auch Pathologen inzwischen als unverzichtbar beschrieben[27]. Sie kann auch im Falle eines niedrigen Malignitätsgrades des Karzinoms relativ häufig brauchbare Aussagen machen[28].
Staging (TNM-System)
Bei der Beurteilung des Tumorstadiums nach dem TNM-System werden Größe und örtliche Ausdehnung des Prostatatumors (T), Lymphknotenbefall (N, von engl. node: Knoten) und Metastasen (M) berücksichtigt. Die Ziffern hinter den Buchstaben stehen für Größe und Ausdehnung des Primärtumors (T1-T4), das Vorliegen von befallenen Lymphknoten (N0-N1) sowie das Vorhandensein und die Verteilung von Fernmetastasen (M0-M1c).
TNM-Klassifikation Stadium Beschreibung Tx Es kann keine Aussage zur Ausdehnung des Primärtumors getroffen werden. T1 Der Tumor ist klein und nicht tastbar. Er wird zufällig im Rahmen einer Prostataoperation wegen BPH oder erhöhter PSA-Werte gefunden (Inzidentaltumor). T2 Der Tumor liegt noch innerhalb der Prostatakapsel. T2a Der Tumor befällt weniger als 50 % eines Seitenlappens. T2b Der Tumor befällt mehr als 50 % eines Seitenlappens. T2c Der Tumor befällt beide Seitenlappen. T3 Der Tumor hat sich über die Prostatakapsel hinaus ausgebreitet. T3a Der Tumor hat sich über die Prostatakapsel ausgebreitet ohne die Samenblasen zu befallen. T3b Der Tumor hat sich über die Prostatakapsel ausgebreitet und befällt die Samenblasen. T4 Der Tumor hat Nachbarstrukturen befallen (infiltriert) oder ist fixiert (unverschieblich). Nx Es kann keine Aussage zu regionären Lymphknotenmetastasen getroffen werden. N0 Keine Metastasen in den regionären Lymphknoten. N1 Metastasen in den regionären Lymphknoten. Mx Es kann keine Aussage zu Fernmetastasen getroffen werden. M0 Keine Fernmetastasen nachweisbar. M1 Der Tumor hat Fernmetastasen gebildet. M1a Metastasen in anderen Lymphknoten (nicht regionäre Lymphknoten). M1b Metastasen in den Knochen. M1c Metastasen in anderen Organen und/oder Strukturen. An der Einordnung in das TNM-Schema orientiert sich die Behandlung. Auch die Prognose kann unter Hinzuziehung weiterer Parameter abgeschätzt werden.
Ein anderes Schema der Stadieneinteilung ist das nach Whitmore-Jewett (modifiziert nach Hopkins). Hier werden die Grade A (mikroskopisches Karzinom, praktisch immer inzidentiell - entspricht T1), B (makroskopisch, auf die Prostata begrenzt - entspricht T2); C (organüberschreitend, auf das kleine Becken begrenzt - entspricht T3/4M0) und D (mit Fernmetastasen - entspricht T1-4M1) unterschieden. Dieses Schema wird im angloamerikanischen Raum bevorzugt, ist aber in Deutschland nicht üblich.
Tumorgröße
Ein recht guter Prädiktor für die Entdifferenzierung, die lokale Invasion der Nachbarorgane und die Wahrscheinlichkeit der Fernmetastasierung ist auch die Tumorgröße. Die „Schwelle der Kurabilität“, also die Größe des Tumors, bis zu welcher man eine Behandlung mit der Zielsetzung der Heilung (kurative Behandlung) als möglich erachtet, wird bei 4 cm³ angesetzt. Ist diese Schwelle überschritten, ist eine Heilung in der Regel nicht mehr möglich. Jedoch können auch durchaus kleinere Tumore bereits metastasiert sein und sich somit einer kurativen Behandlung entziehen. [17]
Therapie
Die Säulen der Therapie sind die chirurgische Intervention, Strahlentherapie und Unterdrückung der Androgenproduktion durch operative oder chemische Kastration.
Operation
Bei lokal begrenztem Prostatakarzinom (T1/2) und guter Konstitution ist die radikale Operation der Prostata, bei der Prostata, Samenbläschen und die regionalen Lymphknoten entfernt werden, die klassische Methode. Diese so genannte „radikale Prostatektomie“ kann auf vier unterschiedliche Arten durchgeführt werden:
- als retropubische radikale Prostatektomie (RRP)
- als radikale perineale Prostatektomie (RPP) durch Schnitt am Damm (zwischen After und Hodensack)
- minimal-invasiv - laparoskopisch(laparoskopisch)
- roboter-assistiert (RARP)
RRP und RPP werden extraperitoneal, also ohne Eröffnung der Bauchhöhle ausgeführt. Die RPP ist weniger zeitaufwändig und mit geringeren Blutungen verbunden als die RRP, aber der Zugang ist relativ schmal. Ein Nachteil ist die fehlende Entfernung der Beckenlymphknoten bei der RPP, so dass ein zweiter Eingriff mittels laparoskopischer pelviner (auf das Becken bezogen) Lymphadenektomie manchmal notwendig ist. Einzelne Zentren haben Techniken publiziert, welche die Lymphknotenentfernung ermöglichen [29]. Bei der minimal-invasiven Methode wird mittels Bauchspiegelungstechnik über einige kleine Schnitte mittels Bauchspiegelung die Prostata operiert. Vorteil im Vergleich zur „offenen“ Operation ist hier vor allem der zumeist geringere Blutverlust und die kleinen Wunden.
Eine Weiterentwicklung der „minimal-invasiven“ Technik ist die roboter-assistierte Prostatektomie. Hier wird mit Hilfe eines Operationsroboters die laparoskopische Technik durchgeführt. Der Roboter wird dabei vom Operateur mittels einer speziellen Konsole fernbedient und führt keine eigenständigen Bewegungen aus. Vorteil für den Operateur gegenüber der Standard-Laparoskopie ist hierbei die nahezu uneingeschränkte Beweglichkeit der Instrumente, die hervorragende Sicht (dreidimensionell über ein Doppel-Optik-System) und die Feinheit der Bewegung, da der Roboter etwa das natürliche Zittern der Hand ausgleicht. Nachteil der Robotertechnik gegenüber der „Standard-Laparoskopie“ sind die vergleichsweise hohen Anschaffungs- und Unterhaltskosten für das Krankenhaus, so dass in Deutschland bisher nur wenige Zentren auf diese Technik zurückgreifen können, bei einigen Abteilungen wird eine private Zuzahlung zur Deckung der Materialkosten verlangt, da die Krankenkassen diese derzeit nicht übernehmen.
Gelingt es bei der Operation, den Tumor vollständig zu entfernen, ist eine Heilung möglich, und die Prognose des weiteren Verlaufes ist günstig. Das Langzeitüberleben liegt zwischen 80 und 90 Prozent, die intraoperative Mortalität unter 1 %. Die Risiken der Operation sind in erster Linie die Gefahr der Stressinkontinenz in etwa 3 bis 5 % und die einer erektilen Dysfunktion durch Verletzung der Nervi cavernosi (Äste der parasympatischen Beckeninnervation) in etwa 80 % der Fälle [30]. Verletzungen des Nervus obturatorius, die im Rahmen der Lymphknotenentfernung auftreten können, oder des Rektums sind selten. In 5 bis 20 % der Fälle kommt es, bedingt durch die Lymphknotenentfernung, zu einer Lymphozele. Als Spätfolge tritt in 3 bis 5 % der Fälle eine Verengung der Verbindungsstelle zwischen Harnröhre und Blase (Anastomose) auf, die so genannte Anastomosenstriktur.
Etliche Zentren bieten eine „nerverhaltende“ Operationsmethode (nach Patrick Walsh) an, bei der die kavernösen Nerven, die in unmittelbarer Lagebeziehung zur Prostata verlaufen, geschont werden. Das Risiko der postoperativen erektilen Dysfunktion kann damit auf 10 % (bei jungen Patienten) bis 50 % (bei älteren Patienten) gesenkt werden, ist aber signifikant von der Erfahrung des Operateurs abhängig und birgt das Risiko einer zu wenig radikalen Ausräumung des Tumors. Es erhöht sich damit das langfristige Risiko eines Lokalrezidives.
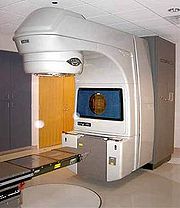
Strahlentherapie (Radiatio)
Eine durch viele Studien belegte gleichwertige und nebenwirkungsärmere Alternative ist bei lokal begrenztem Prostatakarzinom die Bestrahlung. Die Strahlentherapie ist für verschiedene Gruppen von Patienten anwendbar, etwa nach Wiederauftreten eines operierten Tumors, bei metastasierten Tumoren oder auch als Konkurrenzmethode zur Operation. Sie erfolgt entweder von außen (perkutane Strahlentherapie) oder durch „Spickung“ (Brachytherapie) (von griechisch brachy = nah) der Prostata mit radioaktivem Material. Die perkutane Bestrahlung wird mittels Linearbeschleuniger durchgeführt. Bei der Brachytherapie unterscheidet man zwischen der Implantation von „Seeds“ (radioaktiven Partikeln kurzer Halbwertszeit, auch „Low-dose radiation brachy“, LDR-Brachytherapie genannt) und dem „Afterloading“ (High-dose radiation brachy“, HDR-Brachytherapie), wobei für eine (mit einem speziellen Planungsprogramm über PC) vorausberechnete Zeit eine radioaktive Quelle in Hohlnadeln, die in dem zu bestrahlenden kranken Gewebe stecken, eingeführt und anschließend wieder entfernt werden. Die HDR-Brachytherapie kann sowohl mit der perkutanen Bestrahlung kombiniert als auch als alleinige Monotherapie angewandt werden. Die LDR-Brachytherapie („Seeds“) kann nicht mit anderen Formen der Bestrahlung kombiniert werden; diese Therapie stellt eine direkte Alternative zur Operation dar. Vorteile der Bestrahlung sind der Wegfall des OP-Risikos und die Möglichkeit einer ambulanten Behandlung. Nachteile sind Nebenwirkungen wie zeitweiliger Durchfall und Verdauungsstörungen.[31][32]
Bei einer geringen Zahl von Patienten treten nach Strahlentherapie eines Prostatakarzinoms bleibende Schädigungen von Darm (Radioproktitis, Radiocolitis) und Harnblase (Radiocystitis) auf. Auch ein Verlust der Gliedsteife (erektile Dysfunktion) sowie eine Störung der Schließmuskelfunktion des Afters oder der Harnblase ist bei wenigen Patienten nach Bestrahlung eines Prostatakarzinoms beobachtet worden.[33][34] Wenn zum Zeitpunkt der Diagnose bereits eine Absiedelung in andere Organe stattgefunden hat, ist die Erkrankung meist nicht mehr heilbar. Durch Strahlentherapie kann hier jedoch zumindest die Ausbreitung des Krebses verzögert werden. Hier findet vor allem die Bestrahlung von Knochenmetastasen ihre Anwendung, die gefährdete Knochenbezirke stabilisiert und somit erheblich zur Mobilität und Schmerzfreiheit bei Patienten mit metastasierten Tumoren beiträgt.
Hochintensiver fokussierter Ultraschall
Ein seit zehn Jahren in Deutschland angewandtes Verfahren ist der hochintensive fokussierte Ultraschall. Die Methode beruht darauf, dass die gesamte Prostata vom Enddarm aus mit gerichteten Ultraschallwellen erhitzt und das Karzinom damit zerstört wird. Dazu wird der Schallkopf in das Rektum eingeführt. Die Behandlung erfolgt in einer Sitzung, der Krankenhausaufenthalt beträgt nur drei bis fünf Tage. In mehreren Studien mit Nachbeobachtungszeiten von mittlerweile bis zu zehn Jahren wurde die Effektivität und die Sicherheit des Verfahrens nachgewiesen. Die HIFU-Therapie wird von mehr als 30 Zentren in Deutschland angewandt, die Behandlungskosten werden von den gesetzlichen Krankenkassen im Rahmen des DRG-Systems übernommen. Das Verfahren ist für Behandlungen sowohl unter kurativen als auch unter palliativen Gesichtspunkten einsetzbar. Im Gegensatz zu strahlentherapeutischen Verfahren ist es im Rezidivfall wiederholbar, es stellt also keine „therapeutische Sackgasse“ dar. Aufgrund der geringen Belastung für den Patienten, eignet sich HIFU besonders auch für ältere Patienten sowie für die Patienten, die neben dem Krebs noch an weiteren schweren Erkrankungen leiden.
Androgensuppression (kontrasexuelle Therapie)
Eine Hormontherapie in Form eines Hormonentzuges kann hier als (reversible) chemische Kastration durch Gabe von GnRH-Analoga oder - heute seltener - durch (irreversible) chirurgische Kastration (Orchiektomie) durchgeführt werden. Dadurch sinkt der Testosteronspiegel auf rund 5 % ab. Da das Prostatakarzinom in vielen Fällen noch stark testosteronabhängig ist, kommt es bei beiden Verfahren meist zu einem deutlichen Rückgang bzw. Stillstand der Krankheit, so dass der Patient oft über Jahre wieder Ruhe hat. Im Gegensatz zur chirurgischen Kastration entsteht bei der chemischen Kastration ein sogenanntes Flare up, ein wenige Tage dauernder stark beschleunigter Krankheitsverlauf, den man aber durch die kurzzeitige Gabe von Antiandrogenen unterbinden kann und muss. Neuere Untersuchungen konnten jedoch keine verlängerte Lebenserwartung bei den so behandelten Patienten nachweisen[35]. In einer aktuellen US-Studie wurde sogar eine höhere Letalität im Vergleich zu den anderen Therapien nachgewiesen. Als Nebenwirkungen bei beiden Kastrationsverfahren kann es unter anderem zu depressiven Zuständen, zu Anämie, Muskelabbau und als Langzeitwirkung zu Osteoporose kommen, wobei bei Orchiektomie sowohl die psychischen Belastungen durch die irreversible chirurgische Kastration als auch die Osteoporose durch das nicht gleichzeitig supprimierte Hormon LH stärker in Erscheinung treten. Außerdem kommt es zur erektilen Dysfunktion, die meist als nicht allzu schlimm empfunden wird, da auch die Libido nachlässt. Im Laufe der Therapie kann jedoch eine Hormonresistenz des Prostatakarzinomes eintreten. Daher hat diese Methode der Behandlung einen palliativen und keinen kurativen Ansatz.
Chemotherapie
Die Chemotherapie galt beim Prostatakrebs lange als wenig wirksam. Einige Patienten (responder) mit metastasiertem Prostatakarzinom können jedoch von einer Chemotherapie profitieren. Die Ansprechrate liegt bei etwa 20 %. Zumeist hat die Chemotherapie ihren Platz bei der Behandlung des Tumorrezidivs und versagender Hormontherapie. Auch sie ist bisher rein palliativ. Angewendete Therapeutika sind Cyclophosphamid, Doxorubicin (Adriamycin), 5-Fluoruracil, Suramin und andere, für diese konnte jedoch bisher kein Überlebensvorteil gezeigt werden. In einer 2004 in der renommierten Zeitschrift New England Journal of Medicine publizierten Arbeit konnte erstmals ein statistisch signifikanter Überlebensvorteil von median 2,5 Monaten für diejenigen Patienten nachgewiesen werden, welche alle 3 Wochen das Medikament Docetaxel erhielten.[36]
Immuntherapie
Ein völlig neuer therapeutischer Ansatz ist die „Impfung“ mit antigenpräsentierenden Zellen, die mit einem rekombinanten Fusionsprotein (PA2024) beladen werden und die körpereigene Immunantwort stimulieren. Versuche finden derzeit mit einigem Erfolg bei Patienten mit androgen-unabhängigem Prostatakarzinom statt. Diese Patienten konnten bisher nur schwer behandelt werden, da sie auf eine Hormontherapie nicht ansprechen. Die meist gut verträgliche immuntherapeutische Behandlung führte im Rahmen der Studien zu signifikanten Remissionen und zur Verlängerung der Überlebenszeit.[37] Diese Behandlung ist in Deutschland noch nicht zugelassen.
Palliativtherapie
Im fortgeschrittenen Stadium, das keine kurative (heilende) Behandlung mehr erlaubt, können dennoch medizinische Maßnahmen die Beschwerden lindern und die Lebensqualität auf einem passablen Niveau halten. Bisphosphonate wie Zoledronat haben sich als wirksam erwiesen, um osteoporotische Veränderungen im Zuge der antiandrogenen Therapie ebenso wie durch Skelettmetastasen hervorgerufene Frakturen zu reduzieren.[38] Zur Linderung der Knochenschmerzen werden Opioide wie Morphin oder Oxycodon eingesetzt. Durch auf erkannte Knochenmetastasen gerichtete äußere Bestrahlung können ebenfalls für einige Zeit die Schmerzen reduziert werden. Die Injektion bestimmter Radioisotope, wie Strontium-89, Phosphor-32 oder Samarium-153, die sich in stoffwechselaktiven Knochenmetastasen anreichern, haben einen ähnlichen Effekt.
Aktives Beobachten
Unter bestimmten Umständen kann eine Strategie des „Aktiven Beobachtens“ (engl. active surveillance) in Betracht kommen. Daneben kommt watchful waiting, „Beobachten und Abwarten“, zur Anwendung. Letztere Vorgehensweise wird jedoch kaum noch empfohlen.
Faktoren, die „Aktives Beobachten“ sinnvoll erscheinen lassen, sind beispielsweise das Alter des Patienten, der sonstige Gesundheitszustand und der mit Methoden der DNA-Zytometrie gemessene so genannte Ploidiegrad, ein Kennwert für die chromosonale Veränderung der Krebszellen, der auch gut als Verlaufskontrolle geeignet ist. Die DNA-Zytometrie ist eine sehr preiswerte Methode, die von den Krankenkassen bezahlt wird und aus allen Arten von Biopsien (Stanzbiopsie und nebenwirkungsarmer Feinnadel-Aspirationsbiopsie, kurz FNAB) gemacht werden kann. Die einfachste Methode der Verlaufskontrolle ist die regelmäßige Ermittlung der PSA-Verdopplungszeit.
Patienten, die eine Perspektive des „Aktiven Beobachtens“ verfolgen, versuchen, das Fortschreiten eines Karzinoms aktiv, beispielsweise durch die Einnahme von Nahrungsergänzungsmitteln, zu verlangsamen. Von ärztlicher Seite werden diese Bestrebungen teils sehr kritisch beobachtet und als „Vabanquespiel“ bezeichnet, andererseits aber auch unterstützt, um eine so genannte „Übertherapie“ zu vermeiden.
Die Prognose beim „Aktiven Beobachten“ kann unter geeigneten Umständen der der üblichen Therapien entsprechen, ohne dass die Nebenwirkungen der anderen Prostatakrebsbehandlungen in Kauf genommen werden müssen. Wenn diese Strategie erfolgreich ist, verstirbt der Patient mit und nicht an seinem Karzinom.[39]
Prognose und Auswirkungen auf die Lebenserwartung
Die Prognose des Prostatakarzinoms ist für ein bösartiges Geschwulst beziehungsweise eine Krebserkrankung relativ günstig. Zumindest im lokalisierten Stadium (es wird hier auch illustrierend vom „Haustierkrebs“ gesprochen) ist die Lebenserwartung kaum verkürzt. Man nimmt an, dass letztlich weniger als ein Fünftel der an Prostatakrebs Erkrankten auch an ihm versterben, also die Letalität weniger als 20 % beträgt. Grund hierfür ist die späte Manifestation und die zu diesem Zeitpunkt meist bestehende Komorbidität. In einer Studie konnte gezeigt werden, dass im lokalisierten Stadium die Prognose beim Zuwarten (siehe dazu den Abschnitt „Aktives Beobachten“) nicht schlechter ist als bei sofortiger Therapie.[40] Die hohe Mortalität ist somit vor allem auf die auffallend hohe Prävalenz im höheren Lebensalter zurückzuführen.
Das diagnosespezifische Fünfjahresüberleben nach Diagnosestellung liegt bei Tumoren, die auf die Drüse begrenzt sind, bei 80 bis 99 %.[41] Bei gestreuten Tumoren ist dieser Wert jedoch mit höchstens 35 % deutlich geringer.[42] Die Aussicht auf Heilung (also darauf, alle Krebszellen zu zerstören) ist nur bei nicht metastasierten Karzinomen gegeben und dort unter aggressiver Therapie recht gut: auf die Prostata begrenzte Karzinome können zu fast 90 %, die Organkapsel überschreitende zu etwa 50 % definitiv geheilt werden.[43]
Zur genaueren Abschätzung der Prognose dienen die so genannten Partin-Tabellen.[44] Hier wird eine Kombination aus PSA-Wert, Gleason-Score und T-Stadium zur Prognoseeinschätzung herangezogen.
Die hier gemachten Aussagen gelten für das Adenokarzinom der Prostata. Die seltenen neuroendokrinen und kleinzelligen Prostatakarzinome haben eine deutliche schlechtere Prognose mit einer Überlebenszeit von durchschnittlich einem Jahr.
Früherkennung
Nach der AWMF-Leitlinie „Prostatakarzinom“ von 2002 [45] wird allen Männern ab 50 (oder ab 45 bei positiver Familienanamnese, also bei betroffenen Familienangehörigen) zu einer jährlichen Vorsorgeuntersuchung durch einen Facharzt geraten, die neben der rektalen Tastuntersuchung der Prostata auch die Bestimmung des PSA-Wertes durch einen PSA-Test beinhalten soll. Eine zusätzliche Ultraschalluntersuchung der Prostata (TRUS für transrektalen Ultraschall) durch den After ist nicht überall verfügbar und wird in Deutschland derzeit als allgemeine Früherkennungsmaßnahme nicht empfohlen.[5] Ist eine dieser drei Untersuchungen auffällig, werden zur definitiven Diagnose mittels Biopsie, meistens durch Stanzbiopsie, mehrere Gewebeproben entnommen. Die Stanzbiopsie ist auch bei völlig unauffälligem Tastbefund der rektal-digitalen Untersuchung ab einem PSA-Wert von 4 ng/mL angezeigt.
Die Leitlinie zur Früherkennung wird aktuell neu erarbeitet. Ein Problem der bisherigen Empfehlungen wird im relativ geringen positiv prädiktiven Wert (unter 20 %) der PSA-Bestimmung mit festem Schwellenwert gesehen; von der Einführung eines eventuellen Anstieges im Vergleichszeitraum als Verdachtskriterium verspricht man sich eine höhere Effizienz und die Vermeidung unnötiger Biopsien. Zudem geht die Tendenz dahin, festgestellte Karzinome zunächst zu beobachten und nur bei zweifelsfreier Progredienz zu intervenieren. Zur Evaluierung verschiedener Vorsorge-Regimes laufen derzeit zwei große Studien.[5] Als weitere Möglichkeit der Früherkennung des Prostatakrebses wird die Bestimmung des Proteins S100A9 im Blut diskutiert. [46]
In einem Interview mit dem Deutschlandfunk (Ausstrahlung am 4. Januar 2006) wies Robert Allan Weinberg, Krebsforscher am Whitehead-Institut für biomedizinische Forschung in Cambridge bei Boston, darauf hin, dass in den Vereinigten Staaten sechsmal häufiger Prostatakrebs diagnostiziert werde als in Dänemark. Die Sterblichkeit sei in beiden Ländern jedoch gleich hoch.[47]
Forscher um Arun Sreekumar von der University of Michigan in Ann Arbor (USA) identifizierten ein Stoffwechselprodukt namens Sarkosin, welches als sogenannter Biomarker bei einem Prostatatumor in stark erhöhter Konzentration im Urin des Betroffenen nachweisbar ist und ein deutlich besserer Indikator für diese Erkrankung im fortgeschrittneren Stadium mit ihrer jeweilig unterschiedlichen Aggressivität darstellt, als der nicht immer eindeutige PSA-Test. Nach Ansicht der an der Studie beteiligten Wissenschaftler wäre auf Grund dieser Erkenntnis ein neuer und wohl auch zuverlässigerer Test zur Früherkennung von Prostatakrebs möglich.[48]
Siehe auch: Screening
Geschichte
Der älteste bisher nachgewiesene Fall eines metastasierten Prostatakarzinoms wurde anhand von typischen Knochenveränderungen bei einem 2.700 Jahre alten Skelett eines Skythen-Fürsten in Sibirien diagnostiziert. Entdecker waren Forscher der Universität Göttingen um Martin Schultz.[49]
Die Vorsteherdrüse wurde zuerst von dem venezianischen Anatom Niccolò Massa im Jahr 1536 beschrieben. Die erste Illustration veröffentlichte Andreas Vesalius zwei Jahre später. Trotzdem war das Prostatakarzinom bis 1853 unbekannt.[50] Aufgrund der schlechten diagnostischen Optionen und der geringeren allgemeinen Lebenserwartung galt es im 19. Jahrhundert als seltene Krankheit. Die ersten Orchiektomien waren schon um 1890 versucht worden, allerdings mit bescheidenem Erfolg. Die ersten operativen Eingriffe an der Drüse selbst zielten auf Verbesserung des Wasserlassens bei Harnröhrenobstruktion. So wurde die erste radikale Prostatektomie 1904 von Hugh Young im Johns Hopkins Hospital durchgeführt.[51] Mitte des 20. Jahrhunderts wurde die palliative transurethrale Resektion (via Harnröhre) zur Behebung der Harnröhrenobstruktion eingeführt. Die radikale retropubische Prostatektomie wurde 1983 von Patrick Walsh entwickelt.
1941 veröffentlichte Charles Brenton Huggins seine Studienergebnisse, in denen er Östrogene einsetzte, um bei Patienten mit inoperablem Karzinom die Testosteron-Produktion zu hemmen.[52] Die Entdeckung dieser „chemischen Kastration“ brachte ihm 1966 den Nobelpreis ein.
Die Strahlentherapie wurde im frühen 20. Jahrhundert entwickelt und bestand zunächst aus der Einpflanzung von Radium-Implantaten. Die perkutane Bestrahlung wurde seit Mitte des Jahrhunderts durchgeführt. Die erste Beschreibung der Brachytherapie stammt aus dem Jahr 1983.
Veterinärmedizin
Bei Haustieren sind Prostatatumoren wesentlich seltener zu finden als beim Menschen. Bei Katzen sind bisher nur fünf Fälle dieser Erkrankung beschrieben worden. Relativ am häufigsten erkranken Hunde. Hier sind etwa 0,2–0,6 % aller Neubildungen Tumoren der Prostata. Unter den Neoplasien der männlichen Harn- und Geschlechtsorgane beim Hund liegt der Anteil bei 6 %. Bevorzugt erkranken Hunde mittelgroßer bis großer Rassen mit einem Altersdurchschnitt von acht bis zehn Jahren. Eine Kastration hat keinen Einfluss auf einen Rückgang der Erkrankungshäufigkeit; es gibt vielmehr Hinweise, dass die Erkrankung bei kastrierten Rüden häufiger auftritt.[53] Die Erkrankung ist differentialdiagnostisch vor allem von der wesentlich häufiger auftretenden gutartigen Prostatavergrößerung des Hundes abzugrenzen. Ein Tumor der Prostata ist beim Hund fast immer eine bösartige Neubildung, in den meisten Fällen handelt es sich wie beim Menschen um Adenokarzinome. Kastrierte Rüden weisen dagegen bei etwa 50 % der Fälle undifferenzierte Karzinome auf. Als weitere bösartige Neoplasien sind Plattenepithelkarzinome, Übergangsepithelkarzinome und Leiomyosarkome sporadisch beschrieben worden. Lediglich Einzelfälle stellen gutartige Fibrome, Adenome oder Leiomyome dar. Entsprechend ihrem aggressiven Charakter liegen zum Zeitpunkt der Diagnosestellung in 70 bis 80 % der Fälle bereits Metastasen vor. Die Verschleppung der Tumorzellen erfolgt über die Lymphbahn und betrifft in 66 % der Fälle die Lunge. Dieser Verlauf scheint bei kastrierten Rüden häufiger zu sein als bei intakten. Außerdem sind von Metastasen die Lymphknoten im Beckenbereich sowie Leber, Milz, Herz, Nieren, entferntere Lymphknoten, Knochen und die Nebennieren betroffen.
Symptome, Diagnostik, Therapie
Das klinische Erscheinungsbild der Erkrankung ist variabel. Kotabsatzstörungen wie Tenesmus oder Obstipation treten wesentlich häufiger als Beschwerden bei der Miktion auf. Die Neubildung kann Schmerzsymptome im Bereich der Hinterhand hervorrufen, die bei Metastasierung in die Wirbelsäule hinein sogar als Lähmungen imponieren können. Auf rektale Palpation treten in einigen Fällen Schmerzhaftigkeiten auf. Eine Vergrößerung des Organs ist jedoch nicht in allen Fällen nachweisbar. Im Urin lassen sich in zwei Dritteln der Fälle Anzeichen für eine Entzündung oder eine Einblutung nachweisen. Tumorzellen selbst werden hier allerdings nur selten gefunden. Eine Verwendung der humanmedizinischen Marker Saure Phosphatase und Prostataspezifisches Antigen ist umstritten, zumal die humanmedizinischen Tests beim Hund nicht angewendet werden können.
Im Röntgenbild können bei Metastasierung in den betroffenen Organen häufig Veränderungen nachgewiesen werden. Die Prostata selbst ist häufig vergrößert und weist Verkalkungsherde auf. Im Ultraschall ist neben einer Vergrößerung des Organs häufig eine erhöhte Echogenität und in einigen Fällen das Vorhandensein von Zysten nachweisbar. Die definitive Diagnose erfolgt mittels einer transabdominalen oder transrektalen Prostatabiopsie und anschließender pathohistologischer Untersuchung. Eine weitere Möglichkeit besteht in der Durchführung einer Kathetersaugbiopsie, bei welcher mittels eines Harnröhrenkatheters aus dem Bereich der Prostata Zellen angesaugt werden.
Da die meisten Hunde mit einem Tumor der Prostata erst beim Vorliegen von Metastasen vorgestellt werden, ist die Prognose in den meisten Fällen von vornherein ungünstig. Früherkennungsmaßnahmen wie z. B. PSA-Tests werden gegenwärtig noch nicht angeboten. Die mittlere Überlebenszeit nach Diagnosestellung liegt bei drei Monaten. Eine chirurgische Entfernung der Prostata ist durch die meist große Ausdehnung des Tumors oft nicht möglich. Bei intakten Rüden wird die Überlebenszeit auch durch eine Kastration oder die Gabe von Antiandrogenen nicht verbessert. Auch verschiedentlich getestete Chemotherapieprotokolle oder Strahlentherapien verbesserten die Prognose nicht nachweislich.
Quellen
- ↑ Statistisches Bundesamt Deutschland: Eheschließungen, Geborene und Gestorbene 1945-2005. (XLS, 57kB) – Im Jahr 2005 starben insgesamt 388.554 Männer.
- ↑ a b Robert Koch-Institut: Heft 36 Prostataerkrankungen - Gesundheitsberichterstattung des Bundes. (PDF; 0,6MB) – Etwa 11.000 Männer sterben in Deutschland pro Jahr an Prostatakrebs (2005), das sind 2,8 %.
- ↑ a b Schätzung des Robert-Koch-Instituts
- ↑ Statistisches Bundesamt
- ↑ a b c C. Börgermann, H. Rübben: Früherkennung des Prostatakarzinoms. Dtsch Arztebl. (2006) 103(37):2399-2406.
- ↑ N. Breslow et al.: Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France. Int J Cancer (1977) 20(5):680-8. PMID 924691.
- ↑ R.M. Hoffman et al.: Racial and ethnic differences in advanced-stage prostate cancer: the Prostate Cancer Outcomes Study. J Natl Cancer Inst. (2001) 93(5):388-95. PMID 11238701.
- ↑ a b American Cancer Society
- ↑ International Agency for Research on Cancer
- ↑ G.D. Steinberg et al.: Family history and the risk of prostate cancer. Prostate (1990) 17(4):337-47. PMID 2251225.
- ↑ M.A. Khan, A.W. Partin: Vasectomy and Prostate Cancer. Rev Urol. (2004) 6(1):46–47. Freitext
- ↑ Sexual factors and prostate cancer erschienen im British Journal of Urology (BJU International, Bd. 92, S. 211)
- ↑ a b Sonnenmangel fördert Krebs!, Medical Tribune, 42. Jg., Nr. 23, 8. Juni 2007, S. 21
- ↑ Nature: Impact of diet on prostate cancer: a review
- ↑ A. van Bokhoven et al.: Molecular characterization of human prostate carcinoma cell lines. Prostate. (2003) 57(3):205-25 PMID 14518029.
- ↑ Ursus-Nikolaus Riede, Hans-Eckart Schaefer: Allgemeine und spezielle Pathologie. Thieme, Stuttgart 1999. ISBN 3-13-683304-X.
- ↑ a b c d Ronald J. Zagoria, Glenn A. Tung: Genitourinary Radiology. Mosby, St. Louis 1997.
- ↑ H.Y. Wu, H.M. Snyder: Pediatric urologic oncology: bladder, prostate, testis. Urol Clin North Am (2004) 31(3):619-27, xi. PMID 15313070.
- ↑ D.B. Groff: Pelvic neoplasms in children. J Surg Oncol (2001) 77(1):65-71. PMID 11344486.
- ↑ M.D. Krahn et al.: Screening for prostate cancer. A decision analytic view. JAMA (1994) 272(10):773-80. PMID 7521400.
- ↑ B. Scher et al.: Value of 11C-choline-PET and PET-CT in patients with suspected prostate cancer. In: European Journal of Nuclear Medicine. (2007) 34:45–53.
- ↑ S. N. Reske et al.: Imaging Prostate Cancer with 11C-Cholin. Journal of Nuclear Medicine. (2006) 47:1249–1254.
- ↑ F.K. Mostofi et al.: Pathology of carcinoma of the prostate. Cancer. (1992) 70(1 Suppl):235-53. PMID 1376194.
- ↑ Ein Gleason-Score von 7 stellt einen Grenzwert dar. Es ist zu beachten, dass der Gleason-Score kein Laborwert ist, sondern die subjektive Einschätzung des betreffenden Pathologen darstellt, die allerdings natürlich auf einer entsprechenden Erfahrung beruht
- ↑ Vgl. dazu auch die Internetseite Referenzzentrum für Prostata- und Uropathologie
- ↑ So Strohmaier, Klinikum Coburg, in dem GPK-Sonderheft vom Juni 2007 „Krebsfrüherkennung ohne Mythos“, das unter der Adresse www.gek.de/10323 als Download verfügbar ist.
- ↑ Böcking, Alfred: Mit Zellen statt Skalpellen (Sankt Augustin 2006), ISBN 3-86541-177-0
- ↑ http://www.prostatakrebs-bps.de/index.php?option=com_content&task=view&id=354&Itemid=108
- ↑ H. Keller, J. Lehmann, J. Beier: Radical perineal prostatectomy and simultaneous extended pelvic lymph node dissection via the same incision. European Urology 2007, Vol. 52, pages 384
- ↑ Mechanismus der Erektion auf www.urologielehrbuch.de
- ↑ C.M. Yablon, M.P. Banner, P. Ramchandani, E.S. Rovner: Complications of prostate cancer treatment: spectrum of imaging findings. Radiographics (2004) 24(Suppl 1):S181-S194.
- ↑ R.S. Kushwaha, D. Hayne, C.J. Vaizey, E. Wrightham, H. Payne, P.B. Boulos: Physiologic changes of the anorectum after pelvic radiotherapy for the treatment of prostate and bladder cancer. Dis Colon Rectum (2003) 46(9):1182-1188. PMID 12972961.
- ↑ G.S. Merrick, W.M. Butler: Rectal function following permanent prostate brachytherapy. W V Med J (2004) 100(1):18-20. PMID 15119492.
- ↑ G.M. Duchesne, C. Dowling, M. Frydenberg et al.: Outcome, morbidity, and prognostic factors in post-prostatectomy radiotherapy: an Australian multicenter study. Urology (2003) 61(1):179-183. PMID 12559292.
- ↑ Grace L. Lu-Yao et.al.: Survival Following Primary Androgen Deprivation Therapy Among Men With Localized Prostate Cancer [1]
- ↑ [2]
- ↑ P.A. Burch et al.: Immunotherapy (APC8015, Provenge) targeting prostatic acid phosphatase can induce durable remission of metastatic androgen-independent prostate cancer: a Phase 2 trial. Prostate. (2004) 60(3):197-204. PMID 15176049.
- ↑ F. Saad et al.: A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma. J Natl Cancer Inst (2002) 94(19):1458-68 PMID 12359855.
- ↑ Patienteninformation der GEK
- ↑ J.E. Johansson et al.: Fifteen-year survival in prostate cancer. A prospective, population-based study in Sweden. JAMA (1997) 277:467-71 Abstract (deutsch)
- ↑ C.R. Porter et al.: 25-year prostate cancer control and survival outcomes: a 40-year radical prostatectomy single institution series. J Urol. (2006) 176(2):569-74. PMID 16813891.
- ↑ American Cancer Society
- ↑ Deutsche Gesellschaft für Urologie
- ↑ Partin et al.: Contemporary update of the prostate cancer staging nomograms for the new Millennium. Urology (2001) 51:258-264
- ↑ Nicht aktualisierte AWMF-Leitlinie Prostatakarzinom hier online
- ↑ Prostatakrebs-Früherkennung: Protein S100A9 mit hoher Aussagekraft. In: Dtsch Arztebl 2005; 102(33): A-2201 / B-1861 / C-1761. pdf
- ↑ DLF-Interview mit Krebsforscher Robert Weinberg in Forschung Aktuell am 4. Januar 2006
- ↑ http://www.nature.com/nature/journal/v457/n7231/full/nature07762.html A. Sreekumar et al.: Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression. Nature 457, 12 Feb. 2009, S. 910-914, DOI 10.1038/nature07762, ISSN 0028-0836
- ↑ Metastasen beim Skythen-Fürst. In: bild der wissenschaft 3/2008. Konradin Medien GmbH, Leinefelden-Echterdingen. ISSN 0006-2375.
- ↑ J. Adams: The case of scirrhous of the prostate gland with corresponding affliction of the lymphatic glands in the lumbar region and in the pelvis. Lancet (1853) 1:393
- ↑ H.H. Young: Four cases of radical prostatectomy. Johns Hopkins Bull. (1905) 16:315
- ↑ C.B. Huggins, C.V. Hodges: Studies on prostate cancer: 1. The effects of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res. (1941) 1:203
- ↑ R.W. Nelson, C.G. Couto: Innere Medizin der Kleintiere. Urban&Fischer, München und Jena 2006:1004
Literatur
- Emil A. Tanagho, Jack W. McAninch: Smith's General Urology. Appleton & Lange, Norwalk 1995. ISBN 0-8385-8612-0.
- Hans Ulrich Schmelz, Christoph Sparwasser, Wolfgang Weidner: Facharztwissen Urologie. Springer, Heidelberg 2006. ISBN 3-540-20009-6.
- Herbert Rübben: Uroonkologie. Springer, Berlin 2001. ISBN 3-540-67310-5.
- Jürgen Sökeland: Urologie. Thieme, Stuttgart 1993. ISBN 3-13-300611-8.
- M. Kessler: Kleintieronkologie. Parey-Verlag, München 2005. ISBN 3-8304-4103-7.
Weblinks
- Deutsche Gesellschaft für Urologie: Prostatakarzinom
- National Cancer Institute: Prostate cancer (englisch)
- Online-Lehrbuch der Urologie für Ärzte und medizinisches Fachpersonal: Prostatakarzinom
- Universitätsklinik Gießen und Marburg: Prostatakrebs-Therapie
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Prostata spezifisches Antigen — Prostataspezifisches Antigen Oberflächenmodell von PSA mit Substratfragment nach PDB … Deutsch Wikipedia
Krebs (Medizin) — Krebs, Krebsgeschwulst, syn. Malignom bezeichnet in der Medizin einen malignen (bösartigen) Tumor – eine bösartige Gewebeneubildung (Neoplasie). Im engeren Sinn sind die malignen epithelialen Tumoren (Karzinome) und die malignen mesenchymalen… … Deutsch Wikipedia
Prostata-Ca — Klassifikation nach ICD 10 C61 Bösartige Neubildung der Prostata … Deutsch Wikipedia
Prostata-Tumor — Klassifikation nach ICD 10 C61 Bösartige Neubildung der Prostata … Deutsch Wikipedia
Krebs — bösartige Tumorerkrankung; Krebsleiden; Neoplasie; Karzinom; Cancer (lat.) * * * Krebs [kre:ps], der; es, e: 1. im Wasser lebendes, durch Kiemen atmendes, sich kriechend fortbewegendes Tier mit einem Panzer aus Chitin und mindestens vier… … Universal-Lexikon
Knochenmetastase — Klassifikation nach ICD 10 C79.5 Sekundäre bösartige Neubildung des Knochens und des Knochenmarkes … Deutsch Wikipedia
PSA-Screening — Prostataspezifisches Antigen Oberflächenmodell von PSA mit Substratfragment nach PDB … Deutsch Wikipedia
PSA-Test — Prostataspezifisches Antigen Oberflächenmodell von PSA mit Substratfragment nach PDB … Deutsch Wikipedia
PSA Wert — Prostataspezifisches Antigen Oberflächenmodell von PSA mit Substratfragment nach PDB … Deutsch Wikipedia
Softenon — Strukturformel Allgemeines Freiname Thalidomid … Deutsch Wikipedia