- Zincke-Reaktion
-
Die Zincke-Reaktion ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Sie dient der Synthese von Pyridinium-Verbindungen aus Pyridinen und ist nach ihrem Entdecker Theodor Zincke benannt.[1][2][3] Sie ist nicht zu verwechseln mit der Zincke-Suhl-Reaktion oder der Zincke-Nitrierung.
Mechanismus
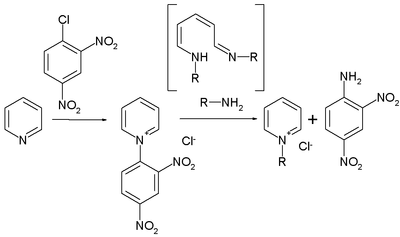
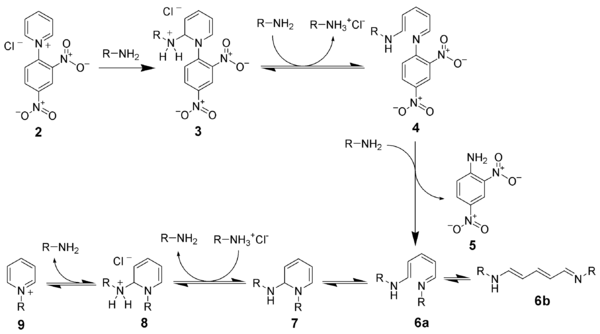
In einem ersten Schritt wird ein Zincke-Salz (2) aus dem eingesetzten Pyridinderivat hergestellt. Dies geschieht durch Umsetzung des Pyridins mit einem elektronenarmen Aromaten, häufig 1-Chlor-2,4-Dinitrobenzol, wobei sich ein Pyridiniumsalz bildet. Das Salz wird anschließend mit zwei Äquivalenten des primären Amins umgesetzt, das jenen Rest trägt, welcher nach Ende der Reaktion am Pyridin verbleiben soll. Das Amin addiert sich zunächst in 2-Position an das Pyridinumsalz (3), was nach Deprotonierung zur Öffnung des Rings führt (4). Durch Substitution des Amins aus dem vorigen Pyridin mit einem dritten Äquivalent des gewünschten Amins wird der gewünschte Rest an die korrekte Position gebracht (6a). Die Reaktion verläuft im weiteren als Umkehr des bisherigen Reaktionsverlaufs. Der Ring wird wieder geschlossen (7), das in 2-Position befindliche Amin protoniert (8) und unter Abspaltung des Amins die gewünschte Pyridiniumverbindung (9) freigesetzt.[4]
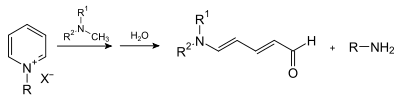
Werden anstelle primärer Amine sekundäre Amine eingesetzt, so werden in Gegenwart von Wasser offenkettige Aldehyde erhalten, welche als Zincke-Aldehyde bezeichnet werden.[5]
Verwendung
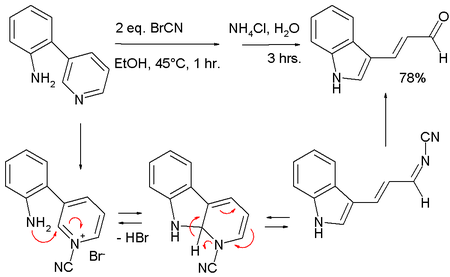
Neben der variablen Synthesemöglichkeit Alkyl- oder Aryl-substituierter Pyridiniumsalze wird die Zincke-Reaktion auch in neueren Fachpublikationen zu aktuellen Problemstellungen eingesetzt. So wurde beispielsweise eine neue Indolsynthese auf Basis der Zincke-Reaktion entwickelt.[6]
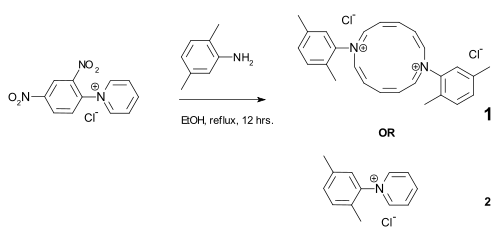
Aufmerksamkeit in der Fachpresse erfuhr die Publikation der Synthese des Diazaannulens (1), die unabhängig von zwei Arbeitsgruppen publiziert wurde.[7][8] Daraufhin verfasste der deutsche Chemiker Manfred Christl einen Leserbrief[9] in dem er zum einen stichhaltig die Synthese des Annulens anzweifelte und zum anderen darauf hinwies, dass es sich bei der eigentlich ablaufenden Reaktion um die seit über hundert Jahren bekannte Zincke-Reaktion handele und das entsprechende Produkt der Zincke-Reaktion (2) gebildet würde und nicht das postulierte Diazaannulen. Beide Gruppen zogen daraufhin ihre Publikationen zurück.[10][11] Über den Fall wurde auch im Spiegel[12] und der Nature[13] berichtet.
Einzelnachweise
- ↑ T. Zincke, G. Heuser, W. Moller: Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte., in: Liebigs Ann. 1904, 330, 361–374; doi:10.1002/jlac.19043300217.
- ↑ T. Zincke, G. Heuser, W. Moller: Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte., in: Liebigs Ann. 1904, 333, 296–345; doi:10.1002/jlac.19043330212.
- ↑ T. Zincke, G. Weisspfenning: Über Dinitrophenylisochinoliniumchlorid und dessen Umwandlungsprodukte., in: Liebigs Ann. 1913, 396, 103–131; doi:10.1002/jlac.19133960107.
- ↑ J. J. Lie: Name Reactions: A Collection of Detailed Mechanisms, 4. Auflage, S. 596, Springer Verlag, Berlin, 2009, ISBN 3-642-01052-0.
- ↑ T. Zincke, W. Wurker: Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte (2. Mittheilung.). Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte., in: Liebigs Ann. 1905, 338, 107–141; doi:10.1002/jlac.19043380107.
- ↑ A. M. Kearney, C. D. Vanderwal: Synthesis of Nitrogen Heterocycles by the Ring Opening of Pyridinium Salts., in: Angew. Chem. 2006, 118, 7967–7970; doi:10.1002/ange.200602996.
- ↑ I. Yamaguchi, Y. Gobara, M. Sato: One-Pot Synthesis of N-Substituted Diaza[12]annulenes., in: Org. Lett. 2006, 8, 4279–4281; doi:10.1021/ol061585q.
- ↑ L. Shi, D. Lundberg, D. G. Musaev, F. M. Menger: [12]Annulene Gemini Surfactants: Structure and Self-Assembly, in: Angew. Chem. 2007, 119, 5993–5995; doi:10.1002/ange.200702140.
- ↑ M. Christl: 1,7-Diaza[12]annulen-Derivate? 100 Jahre alte Pyridiniumsalze!, in: Angew. Chem. 2007, 119, 9312–9313; doi:10.1002/ange.200704704.
- ↑ I. Yamaguchi, Y. Gobara, M. Sato: One-Pot Synthesis of N-Substituted Diaza[12]annulenes., in: Org. Lett. 2007, 9, 5139; doi:10.1021/ol702583k.
- ↑ L. Shi, D. Lundberg, D. G. Musaev, F. M. Menger: Berichtigung: [12]Annulene Gemini Surfactants: Structure and Self-Assembly, in: Angew. Chem. 2007, 119, 9295; doi:10.1002/ange.200790248.
- ↑ Spiegel-Artikel: Wissenschaftsposse: Ahnungslose Chemiker entdecken Verbindung zum zweiten Mal., 6 Dezember 2007
- ↑ K. Sanderson: Where have I seen that before? 103-year-old chemical reaction pops up again., in: Nature News 2007; doi:10.1038/news.2007.341
Wikimedia Foundation.